- 身边的化学物质身边的化学物质
- 空气和氧气空气和氧气
- 空气的成分空气的成分
- 氧气的性质和用途氧气的性质和用途
- 氧气的制取氧气的制取
- 水和氢气水和氢气
- 自然界的水自然界的水
- 氢气的性质及制取氢气的性质及制取
- 碳和碳的化合物碳和碳的化合物
- 碳单质碳单质
- 一氧化碳和二氧化碳一氧化碳和二氧化碳
- 二氧化碳的实验室制法二氧化碳的实验室制法
- 金属与金属材料金属与金属材料
- 金属材料金属材料
- 金属的化学性质金属的化学性质
- 金属资源的利用与保护金属资源的利用与保护
- 生活中常见的化合物生活中常见的化合物
- 常见的酸和碱常见的酸和碱
- 中和反应 pH中和反应 pH
- 常见的盐常见的盐
- 复分解反应复分解反应
- 化学肥料化学肥料
- 物质构成和变化物质构成和变化
- 物质的分类物质的分类
- 物质的微粒性物质的微粒性
- 分子分子
- 原子原子
- 离子离子
- 元素元素
- 物质组成的表示物质组成的表示
- 相对原子质量相对原子质量
- 相对分子质量相对分子质量
- 化学式化学式
- 化合价化合价
- 化学方程式化学方程式
- 物质变化物质变化
- 物理变化与化学变化物理变化与化学变化
- 化学反应类型化学反应类型
- 质量守恒定律质量守恒定律
- 金属活动性顺序金属活动性顺序
- 溶液溶液
- 化学基本实验与科学探究化学基本实验与科学探究
- 常用化学仪器常用化学仪器
- 化学实验基本操作化学实验基本操作
- 常见气体的实验室制取常见气体的实验室制取
- 物质鉴别物质鉴别
- 粗盐提纯粗盐提纯
- 粗盐提纯粗盐提纯
- 配制溶质质量分数一定的溶液配制溶质质量分数一定的溶液
- 化学计算化学计算
- 有关化学式的计算有关化学式的计算
- 有关化学方程式的计算有关化学方程式的计算
- 有关溶液的计算有关溶液的计算
- 综合计算综合计算
- 化学与社会发展化学与社会发展
- 人类重要的营养物质人类重要的营养物质
- 化学元素与人类健康化学元素与人类健康
- 有机合成材料有机合成材料
- 化学与能源化学与能源
- 燃烧与灭火燃烧与灭火
- 化石燃料化石燃料
- 能源的利用与开发能源的利用与开发
《中和反应 pH》知识速查
中和反应
1.【实验】中和反应实验
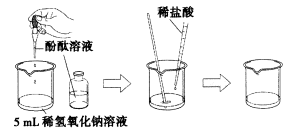
实验操作:在烧杯中加人约5mL稀氢氧化钠溶液,滴入几滴酚酞溶液。用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成无色为止。
实验现象:滴人酚酞溶液后变为红色;慢慢滴人稀盐酸,溶液恰好变为无色。
实验结论:氢氧化钠与稀盐酸能发生反应。
说明:
(1)有些酸和碱反应生成盐和水时从外观上看无明显现象,但由于酸碱指示剂在酸性、碱性、中性溶液中可显示不同的颜色,因此加入指标剂可以借助指示剂颜色的变化判断中和反应是否发生以及确定中和反应的终点。如NaOH溶液里加入酚酞溶液显红色,当滴加的盐酸和氢氧化钠恰好反应时,酚酞由红色变为无色,中和反应达到终点。如果使用石蕊溶液,溶液由蓝色变为紫色,颜色变化不明显。
(2)实验时用玻璃棒不断搅拌,可以使稀盐酸和氢氧化的溶液充分接触,反应迅速、完全。
(3)实验时用胶头滴管慢慢滴入,便于控制加入酸的量,同时也为了清楚地看出指示剂颜色的变化。
(4)实验时要注意观察溶液颜色的变化,当观察到溶液由红色恰好变为无色时,立即停止滴加,防止盐酸过量。
2.中和反应
(1)概念:酸与碱作用生成盐和水的反应,叫做中和反应。
(2)表达式:酸+碱→盐+水
例如
$ HCl +NaOH \stackrel {} {=} NaCl + H_ {2}O $
$ H_ {2}SO_ {4} +2NaOH \stackrel {} {=} Na_ {2}SO_ {4} + 2H_ {2}O $
$ HCl +KOH \stackrel {} {=} KCl + H_ {2}O $
$ H_ {2}SO_ {4} +2KOH \stackrel {} {=} K_ {2}SO_ {4} + 2H_ {2}O $
$ 2HCl +Ca(OH)_ {2} \stackrel {} {=} CaCl_ {2} + 2H_ {2}O $
$ H_ {2}SO_ {4}+Ca(OH)_ {2} \stackrel {} {=} CaSO_ {4}+ 2H_ {2}O $
注意:
(1)酸碱中和反应生成盐和水,但是有盐和水生成的反应不一定是中和反应,如反应$ 2Na(OH)_ {2} + CO_ {2} \stackrel {} {=} Na_ {2}CO_ {3} + H_ {2}O $ 中虽有盐和水生成,但反应物不是酸和碱,故此类反应不属于中和反应,即中和反应的反应物特指酸和碱。
(2)并不是所有的中和反应都没有明显现象,
如$ H_ {2}SO_ {4}+Cu(OH)_ {2} \stackrel {} {=} CuSO_ {4}+ 2H_ {2}O $溶液由无色变成蓝色等。
(3)中和反应的实质
①盐酸、硫酸等酸溶液中都可以解离出氢离子和酸根离子,如图所示。
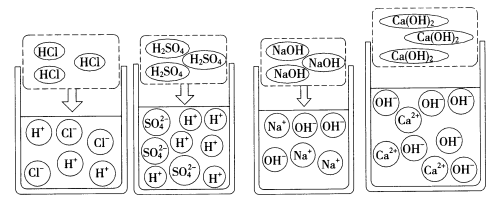
酸具有相似的化学性质的原因是酸溶液中都含有H+。
②氢氧化钠、氢氧化钙等碱溶液中都能解离出自由移动的金属离子(或NH4+)和OH-,如图所示。

碱溶液中都含有OH-,所以碱溶液也具有相似的化学性质。
③中和反应的实质就是酸溶液中的H+与碱溶液中的OH-结合生成水分子的过程。如$ HCl +NaOH \stackrel {} {=} NaCl + H_ {2}O $中,实际参加反应的是H+和OH-,即H++OH-=H2O(如图所示),溶液中Na+和Cl-的个数不变。
中和反应在实际中的应用
应用 | 实例 | |
调节土壤的酸碱性 | 根据土壤情况,加酸性或碱性物质,调节土壤酸碱性,使土壤适合作物生长 | 若土壤呈酸性,人们可以将适量的熟石灰加人土壤中以中和其酸性物质 |
若土壤呈碱性,可以通过加碳酸水来中和土壤中的碱性物质 | ||
处理工厂的废水 | 工厂里的废水常呈酸性或碱性,需要加碱或酸进行中和等一系列处理才能排放 | 硫酸工厂的废水呈酸性,用熟石灰中和Ca(OH)2+H2SO4=CaSO4+2H2O |
印染厂的废水(含NaOH)呈碱性,用废硫酸中和 2NaOH+H2SO4=Na2SO4+2H2O | ||
用于医疗 | 利用碱性物质治疗胃酸(盐酸)过多 | 用含有Al(OH)3或Mg(OH)2的药物治疗胃酸过多 Al(OH)3+3HCl=AlCl3+3H2O Mg(OH)2+2HCI =MgCl2+2H2O |
利用碱性物质治疗蚊虫叮咬 | 将肥皂水或稀氨水(NH3·H2O)涂抹患处,中和蚊虫分泌的蚁酸 | |
用于生活 | 食用皮蛋时加入食醋 | 皮蛋中含有碱性物质,加入食醋后,可以发生中和反应,除去涩味,使皮蛋变得可口 |
洗发时 | 洗发时先用弱碱性的洗发剂,再用弱酸性的护发素 | |
调节溶液酸碱性 | 在科学实验中经常把溶液的酸碱性控制在一定范围内,如果溶液酸性或碱性太强,就需要用碱或酸中和 | |
说明:
(1)农作物一般适宜在中性或接近中性的土壤中生长,土壤的酸性或碱性太强都不利于农作物的生长。
(2)氢氧化铝[AL(OH)3]是一种常用的中和胃酸过多的药物,但由于反应后生成的Al3+对人体有不良作用,已逐渐被其他药物取代。NaOH具有强烈的腐蚀性,在治疗胃酸过多和改良酸性土壤时不能使用,防止发生危险和对农作物造成伤害。
(3)改良酸性土壤,处理工厂的酸性废水,通常用熟石灰而不用氢氧化钠,因为熟石灰价格便宜,比氢氧化钠腐蚀性弱。
溶液酸碱度的表示方法——pH
1.溶液的酸碱性
溶液的酸碱性是指溶液显酸性、中性或碱性,可以利用酸碱指示剂来粗略测定溶液的酸碱性。
2.溶液的酸碱度
(1)概念:溶液的酸碱度是指溶液的酸碱性的强弱程度,即酸碱度是定量表示溶液酸碱性强弱的一种方法。
(2)表示方法:溶液的酸碱度通常用pH表示。pH的范围通常为0-14。
(3)pH与溶液酸碱性的关系

pH范围 | 溶液的酸碱性 | 举例 |
pH>7 | 碱性,pH越大,碱性越强 | 碱溶液及少数盐溶液。如NaOH溶液、Na2CO3溶液 |
pH=7 | 中性 | 大多数盐溶液及水。如NaCl溶液、H2O |
pH<7 | 酸性,pH越小,酸性越强 | 酸溶液及少数盐溶液。如盐酸、CuSO4溶液 |
拓展:
(1)pH是溶液中所含H+浓度大小的一种表示方法。溶液中H+浓度越大,酸性越强,pH越小;OH-浓度越大,碱性越强,pH越大;当溶液中H+浓度与OH-浓度相等时,溶液的pH=7,呈中性。
(2)碱性溶液中一定含较多OH-,但不一定是碱的溶液,例如Na2CO3是盐类物质,但它的溶液显碱性;酸性溶液中一定含较多H+,但不一定是酸的溶液,如NH4Cl等某些盐溶液显酸性。
(3)pH能表示溶液酸碱性的强弱程度,但不能确定是酸的溶液还是碱的溶液。
pH的测定方法
1.测定方法
测定溶液的pH最简便的方法是使用pH试纸。pH试纸可以粗略地测定溶液的酸碱度。
2.【实验】pH的测定和溶液的酸碱性
实验操作 | 实验现象 | 实验结论 | |
在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒蘸取溶液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出该溶液的pH | (较浓)稀盐酸 | pH=1 | 显酸性 |
(较稀)稀盐酸 | pH=2 | ||
(较浓)稀硫酸 | pH=1 | 显酸性 | |
(较稀)稀硫酸 | pH=2 | ||
(较稀)氢氧化钠溶液 | pH=12 | 显碱性 | |
(较浓)氨氧化钠溶液 | pH=13 | ||
15%的氯化钠溶液 | pH=7 | 显中性 | |
10%的氯化钠溶液 | pH=7 | ||
说明:
(1)不能直接将pH试纸浸入待测液中,这样会污染待测液。
(2)不能先用蒸馏水将pH试纸润湿,再向试纸上滴待测液。如果将试纸先用蒸馏水润湿,则待测溶液被稀释,所测得的pH就不准确。测酸性溶液时,酸性溶液被稀释,酸性减弱,pH偏大;测碱性溶液时,碱性溶液被稀释,碱性减弱,pH偏小;测中性溶液时无影响。
(3)用广泛pH试纸测得的溶液pH比较粗略,读数为0-14的整数,测不出带有小数的数值。
(4)检验气体的酸性或碱性,可先将试纸润湿后再用。
(5)测定溶液的pH还可以使用pH计。pH计又叫酸度计,是用来精确测定溶液pH的仪器。pH计有不同的型号,在精度和外观等方面有所不同。
拓展:
(1)酸性溶液加水稀释pH变大,但只能接近7,不会大于或等于7(酸性溶液不会稀释成碱性或中性溶液),如图所示。
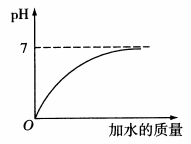
(2)碱性溶液加水稀释pH变小,但只能接近7,不会小于或等于7(碱性落液不会稀释成酸性或中性溶液),如图所示。

(3)中性溶液加水稀释时pH不变,pH=7,溶液仍呈中性。