- 身边的化学物质身边的化学物质
- 空气和氧气空气和氧气
- 空气的成分空气的成分
- 氧气的性质和用途氧气的性质和用途
- 氧气的制取氧气的制取
- 水和氢气水和氢气
- 自然界的水自然界的水
- 氢气的性质及制取氢气的性质及制取
- 碳和碳的化合物碳和碳的化合物
- 碳单质碳单质
- 一氧化碳和二氧化碳一氧化碳和二氧化碳
- 二氧化碳的实验室制法二氧化碳的实验室制法
- 金属与金属材料金属与金属材料
- 金属材料金属材料
- 金属的化学性质金属的化学性质
- 金属资源的利用与保护金属资源的利用与保护
- 生活中常见的化合物生活中常见的化合物
- 常见的酸和碱常见的酸和碱
- 中和反应 pH中和反应 pH
- 常见的盐常见的盐
- 复分解反应复分解反应
- 化学肥料化学肥料
- 物质构成和变化物质构成和变化
- 物质的分类物质的分类
- 物质的微粒性物质的微粒性
- 分子分子
- 原子原子
- 离子离子
- 元素元素
- 物质组成的表示物质组成的表示
- 相对原子质量相对原子质量
- 相对分子质量相对分子质量
- 化学式化学式
- 化合价化合价
- 化学方程式化学方程式
- 物质变化物质变化
- 物理变化与化学变化物理变化与化学变化
- 化学反应类型化学反应类型
- 质量守恒定律质量守恒定律
- 金属活动性顺序金属活动性顺序
- 溶液溶液
- 化学基本实验与科学探究化学基本实验与科学探究
- 常用化学仪器常用化学仪器
- 化学实验基本操作化学实验基本操作
- 常见气体的实验室制取常见气体的实验室制取
- 物质鉴别物质鉴别
- 粗盐提纯粗盐提纯
- 粗盐提纯粗盐提纯
- 配制溶质质量分数一定的溶液配制溶质质量分数一定的溶液
- 化学计算化学计算
- 有关化学式的计算有关化学式的计算
- 有关化学方程式的计算有关化学方程式的计算
- 有关溶液的计算有关溶液的计算
- 综合计算综合计算
- 化学与社会发展化学与社会发展
- 人类重要的营养物质人类重要的营养物质
- 化学元素与人类健康化学元素与人类健康
- 有机合成材料有机合成材料
- 化学与能源化学与能源
- 燃烧与灭火燃烧与灭火
- 化石燃料化石燃料
- 能源的利用与开发能源的利用与开发
《化学方程式》考点速查
化学方程式
木炭在氧气中燃烧生成二氧化碳,分析如下:

用文字表示化学反应书写起来很麻烦,国际上不能通用,且不能反映物质间的量的关系,也不能表示物质的组成。化学家用化学式等国际通用的化学语言来表示反应物和生成物的组成,以及各物质间的量的关系。
1.定义
用化学式来表示化学反应的式子,叫做化学方程式。
化学式表示的是物质组成,化学方程式表示的是化学反应。
2.化学方程式的意义(如下表所示)
化学方程式的意义 | 实例($2H_{2}O\stackrel{通电}{=}2H_{2}↑+O_{2}↑$) | |
质的方面 | 表示反应物、生成物和反应条件 | 反应物是水,生成物是氢气和氧气,反应条件是通电 |
量的方面 | ①表示反应物、生成物之间的质量比 各物质间质量比=相对分子质量(或相对原子质量)与化学计量数的乘积之比 ②表示反应物、生成物之间的粒子个数比(即化学式前面的化学计量数之比) |  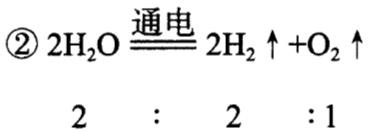 |
说明:化学计量数是指化学方程式中每种物质化学式前面的数字,如上述反应中H2前面的2,O2前面的1等。
3.化学方程式的读法(以 $2H_{2}O\stackrel{通电}{=}2H_{2}↑+O_{2}↑$ 为例)
质的方面:水在通电的条件下生成了氢气和氧气。
量的方面:在通电条件下,每9份质量的水完全分解生成1份质量的氢气和8份质量的氧气,或每2个水分子完全分解,生成2个氢分子和1个氧分子。
4.化学方程式提供的信息
(1)反应物、生成物、反应条件。
(2)反应物与生成物之间的质量比。
(3)反应物与生成物之间的粒子个数比。
(4)反应前后质量守恒。
(5)反应类型等。
粒子个数比:就是化学方程式中各物质化学式前的化学计量数之比。各物质的质量比等于各物质的相对分子质量(或相对原子质量)与化学计量数的乘积之比。
化学方程式书写的注意事项
一、化学方程式的书写原则
(1)必须以客观事实为基础,不能凭空臆想、臆造事实上不存在的物质或化学反应。
(2)遵守质量守恒定律,“![]() ”两边各原子的种类与数目必须相等。
”两边各原子的种类与数目必须相等。
二、化学方程式的书写步骤(以高锰酸钾受热分解为例)
(1)写:根据实验事实写出反应物和生成物的化学式(反应物在左,生成物在右),并在反应物和生成物之间画“![]() ”。
”。
$KMnO_ {4} -K _ {2} MnO _ {4} + MnO _ {2} + O _ {2}$
(2)配:配平化学方程式的目的是使“![]() ”两边的原子种类与数目相等,使之遵守质量守恒定律。配平化学方程式后,要检查。
”两边的原子种类与数目相等,使之遵守质量守恒定律。配平化学方程式后,要检查。
$2KMnO_ {4} -K _ {2} MnO _ {4} + MnO _ {2} + O _ {2}$
(3)注:注明化学反应发生的条件(如点燃、加热、催化剂等),标出生成物状态。
$2KMnO_ {4} \stackrel{△}{-}K _ {2} MnO _ {4} + MnO _ {2} + O _ {2}↑$
(4)等:把“![]() ”改成“
”改成“![]() ”。
”。
$2KMnO_ {4} \stackrel{△}{=}K _ {2} MnO _ {4} + MnO _ {2} + O _ {2}↑$
(5)查:检查化学式书写是否正确,化学方程式是否配平,反应条件和物质状态标注是否准确、恰当。
三、书写注意事项
(1)正确区分反应条件和反应过程,如“点燃”和“燃烧”,“通电”和“电解”等,“点燃”“通电”是反应条件,“燃烧”“电解”是反应过程。
(2)不要混淆“点燃”与“加热”,二者表示的意义不同。
“点燃”是指在有外界热源(如酒精灯、火柴等)提供热量的条件下,使可燃物发生燃烧,一旦燃烧发生后,热源可撤掉。
“加热”是指热源始终为反应提供热量,维持反应的进行,一旦撤掉热源,反应就会停止,“加热”可用符号“△”表示,一般指温度在400~500℃。
(3)若反应条件有两个或多个,“△”写在“![]() ”下边,其他条件写在“
”下边,其他条件写在“![]() ”上边。
”上边。
(4)若反应所需温度较高,超过了酒精灯的温度(600℃),要用“高温”表示,也可以不区分加热或高温,直接写给定的具体反应温度。
(5)“↑”或“↓”是表示生成物状态的符号,无论反应物是气体还是固体,都不能标注。常温下,若反应物中无气体,生成物中有气体,则生成物中气体化学式的右边加“↑”;若反应物中有气体,则生成物中的气体化学式的右边不加“↑”。若反应在溶液中进行,反应物中无固体,生成的固体化学式的右边加“↓”;若反应物中有固体,生成的固体化学式的右边不加“↓”。
化学方程式的配平方法
一、化学方程式的配平依据
化学方程式的配平依据是质量守恒定律,在化学式前面配上适当的化学计量数,使式子左、右两边每一种元素的原子数目相等。
二、化学方程式的配平方法
(1)最小公倍数法
配平化学方程式常用的方法是最小公倍数法(以磷在空气中燃烧为例)。
①首先找出其中出现次数较多且原子个数相差较多的原子作为配平起点,求出它们的最小公倍数,再由最小公倍数确定相关化学式的化学计量数,如$P+O_{2} - P_{2}O_{5}$中,$O_{2}$和$P_{2}O_{5}$中$O$的最小公倍数为2×5=10。
②用最小公倍数分别除以含有该元素的化学式中的原子个数,其商就是该化学式的化学计量数。如$P_{2}O_{5}$中含有5个氧原子,则$P_{2}O_{5}$的化学计量数为$\frac{10}{5}$=2;$O_{2}$中含有2个氧原子,则$O_{2}$的化学计量数为$\frac{10}{2}$=5。
③由已有的化学计量数,确定其他化学式的化学计量数,并把短线改为等号,得出配平的化学方程式为$4P+5O_{2}=2P_{2}O_{5}$,然后注明“反应条件”“↑”和“↓”等,即$4P+5O_{2}\stackrel{点燃}{=}2P_{2}O_{5}$。
(2)奇数配偶法
如配平$O_{2}+FeS_{2}-Fe_{2}O_{3}+SO_{2}$,观察该反应,氧元素出现次数最多(3次)且在$Fe_{2}O_{3}$中个数为奇数3,因此可直接在其前面加2。根据铁的原子个数可确定$FeS_{2}$的化学计量数为4,再根据硫的原子个数确定$SO_{2}$的化学计量数为8,最后根据氧原子的个数确定$O_{2}$的化学计量数为11。配平后的化学方程式为$11O_{2}+4FeS_{2}\stackrel{高温}{=}2Fe_{2}O_{3}+8SO_{2}$。
(3)观察法
如配平$CO+Fe_{2}O_{3}-Fe+CO_{2}$,观察发现此反应的特点是1个$CO$分子结合1个氧原子生成1个$CO_{2}$分子,而1个$Fe_{2}O_{3}$分子可提供3个氧原子,需要3个$CO$分子与之结合生成3个$CO_{2}$分子,因此$CO$、$CO_{2}$的化学计量数均为3,$Fe$的化学计量数为2,把短线改为等号:$3CO+Fe_{2}O_{3}\stackrel{高温}{=}2Fe+3CO_{2}$。
(4)定一法
配平步骤为:
①将化学方程式中最复杂的化学式的化学计量数定为1,作为配平起点;
②根据原子个数守恒确定其他物质的化学计量数(可为分数);
③若配平后化学计量数出现分数,则在式子两边同时乘以其分母,使化学计量数之比变成最简整数比。如配平$CH_{3}OH+O_{2}-CO_{2}+H_{2}O$。所给化学方程式中,$CH_{3}OH$的化学式最复杂,将其化学计量数定为1,作为配平起点;通过观察,根据碳原子守恒,在$CO_{2}$前配上化学计量数1,根据氢原子守恒,在$H_{2}O$前配上化学计量数2,故生成物中含有氧原子数为1×2+2×1=4,而反应物$CH_{3}OH$中含有一个氧原子,故在$O_{2}$前配上化学计量数$\frac{4-1}{2}=\frac{3}{2}$;通分化整,将化学方程式两边物质的化学计量数都乘以2,去掉$O_{2}$的化学计量数的分母,化学方程式即配平完成。配平结果为$2CH_{3}OH+3O_{2}\stackrel{点燃}{=}2CO_{2}+4H_{2}O$。
最小公倍数法:首先找出其中出现次数较多且原子个数相差较大的原子作为配平起点,求出该原子两边原子个数的最小公倍数,再由最小公倍数确定相关化学式的化学计量数,配平化学方程式。
奇数配偶法:首先选出反应式两边原子个数一奇一偶的元素作为配平的起点,若有几种元素在反应式两边同时出现奇偶数时,从出现次数最多的那种元素开始,将奇数配成偶数。然后,以该化学式和所配化学计量数为依据,找出其他化学式的化学计量数,配平化学方程式。
定一法:在反应物或生成物中找出一种比较复杂的或元素在物质中出现次数比较多的物质,将它的化学计量数定为1。以此化学式为准,来确定其他化学式的化学计量数。
根据化学方程式计算的依据
1.理论依据
质量守恒定律。如∶已知氯酸钾、二氧化锰的混合物26g,加热后完全反应,最后剩余物质的质量为16.4g,生成氧气的质量如下所示。
根据质量守恒定律可知生成氧气的质量为26g-16.4g=9.6g。
2.基本依据
化学方程式中各反应物、生成物之间的质量比为一定值。如:电解水反应中,参加反应的水及生成的氢气、氧气的质量比如图所示。即每36份质量的水在通电时发生反应生成4份质量的氢气和32份质量的氧气。
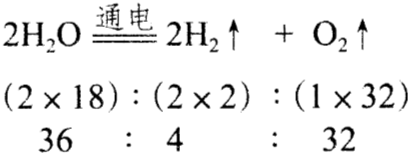
3.等量关系
A、B、C、D四种物质在一定条件下发生反应:$a A + b B = x C + y D$,已知A、B、C、D的相对分子质量依次为M1、M2、M3、M4,a、b、x、y为配平的化学计量数,当A的质量为m1、B的质量为m2时,两者恰好完全反应生成C、D的质量依次为m3和m4,则有如图所示等量关系式。
