- 身边的化学物质身边的化学物质
- 空气和氧气空气和氧气
- 空气的成分空气的成分
- 氧气的性质和用途氧气的性质和用途
- 氧气的制取氧气的制取
- 水和氢气水和氢气
- 自然界的水自然界的水
- 氢气的性质及制取氢气的性质及制取
- 碳和碳的化合物碳和碳的化合物
- 碳单质碳单质
- 一氧化碳和二氧化碳一氧化碳和二氧化碳
- 二氧化碳的实验室制法二氧化碳的实验室制法
- 金属与金属材料金属与金属材料
- 金属材料金属材料
- 金属的化学性质金属的化学性质
- 金属资源的利用与保护金属资源的利用与保护
- 生活中常见的化合物生活中常见的化合物
- 常见的酸和碱常见的酸和碱
- 中和反应 pH中和反应 pH
- 常见的盐常见的盐
- 复分解反应复分解反应
- 化学肥料化学肥料
- 物质构成和变化物质构成和变化
- 物质的分类物质的分类
- 物质的微粒性物质的微粒性
- 分子分子
- 原子原子
- 离子离子
- 元素元素
- 物质组成的表示物质组成的表示
- 相对原子质量相对原子质量
- 相对分子质量相对分子质量
- 化学式化学式
- 化合价化合价
- 化学方程式化学方程式
- 物质变化物质变化
- 物理变化与化学变化物理变化与化学变化
- 化学反应类型化学反应类型
- 质量守恒定律质量守恒定律
- 金属活动性顺序金属活动性顺序
- 溶液溶液
- 化学基本实验与科学探究化学基本实验与科学探究
- 常用化学仪器常用化学仪器
- 化学实验基本操作化学实验基本操作
- 常见气体的实验室制取常见气体的实验室制取
- 物质鉴别物质鉴别
- 粗盐提纯粗盐提纯
- 粗盐提纯粗盐提纯
- 配制溶质质量分数一定的溶液配制溶质质量分数一定的溶液
- 化学计算化学计算
- 有关化学式的计算有关化学式的计算
- 有关化学方程式的计算有关化学方程式的计算
- 有关溶液的计算有关溶液的计算
- 综合计算综合计算
- 化学与社会发展化学与社会发展
- 人类重要的营养物质人类重要的营养物质
- 化学元素与人类健康化学元素与人类健康
- 有机合成材料有机合成材料
- 化学与能源化学与能源
- 燃烧与灭火燃烧与灭火
- 化石燃料化石燃料
- 能源的利用与开发能源的利用与开发
《质量守恒定律》知识速查
质量守恒定律的内容
质量守恒定律的内容
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,这个规律就叫做质量守恒定律。
说明:
(1)质量守恒定律适用于所有的化学反应,但不能用于解释物理变化。
(2)质量守恒定律强调的是“质量守恒”,不包括体积等其他方面的守恒。
(3)注意正确认识“参加化学反应”的物质,如有的反应需要使用催化剂,不能将催化剂视为反应物;有的物质没有全部参加反应,在利用该定律计算生成物的总质量时,不能将未反应的物质的质量计入反应物的质量总和当中。
(4)参加化学反应的“各物质”与生成的“各物质”,应当包括固态、液态、气态所有的物质。
(5)“质量和”相等,而非“质量比”相等。
(6)质量守恒中的“守恒”是指物质的总质量守恒,而非某一种或几种物质的质量守恒。
质量守恒定律实验探究
【探究】用不同实验方案探究化学反应前后物质的质量关系
方案一 红磷燃烧前后质量的测定(如图所示)
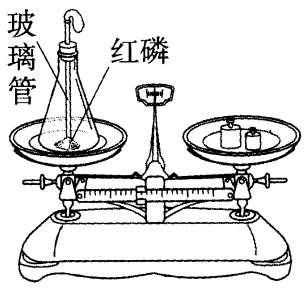
实验步骤:
(1)在底部铺有细沙的锥形瓶中,放入一小堆干燥的红磷。
(2)在锥形瓶口的橡胶塞上安装一根玻璃管,在其上端系牢一个小气球,并使玻璃管下端能与红磷接触。
(3)将锥形瓶和玻璃管放在托盘天平上用砝码平衡,记录所称的质量m1。
(4)取下锥形瓶,将橡胶塞上的玻璃管放到酒精灯火焰上灼烧至红热后,迅速用橡胶塞将锥形瓶塞紧,并将红磷引燃。
(5)待锥形瓶冷却后,重新放到托盘天平上,记录所称的质量m2。
(6)比较m1和m2的大小。
反应的文字表达式:
$磷(P) + 氧气(O _ {2}) \stackrel { \text { 点燃 } } { → } 五氧化二磷(P _ {2} O _ {5})$
实验现象:红磷燃烧产生大量白烟;玻璃管上端的小气球先膨胀后变瘪;红磷燃烧前后的质量m1=m2。
实验现象分析:
(1)红磷燃烧放热,锥形瓶中空气膨胀,小气球鼓起;冷却后,红磷燃烧消耗了瓶中的氧气,生成P2O5固体,锥形瓶中气体压强变小,小气球变瘪。
(2)反应前物质总质量m1=装置+细沙+红磷+氧气+其他气体,反应后物质总质量m2=装置+细沙+余下的红磷+五氧化二磷+其他气体。
因为m1=m2,所以参加反应的红磷和氧气质量总和=五氧化二磷的质量。
实验结论:参加化学反应的红磷和氧气的质量总和,等于反应后生成的五氧化二磷的质量。
方案二 铁钉与硫酸铜溶液反应前后质量的测定(如图所示)

实验步骤:
(1)在锥形瓶中加入适量硫酸铜溶液,塞好橡胶塞。
(2)将几根铁钉用砂纸打磨干净,将盛有硫酸铜溶液的锥形瓶和铁钉一起放在托盘天平上称量,记录所称的质量m1。
(3)将铁钉浸到硫酸铜溶液中,观察实验现象。
(4)待反应一段时间后溶液颜色改变时,将盛有反应后溶液和铁钉的锥形瓶放在托盘天平上称量,记录所称的质量m2。
(5)比较m1和m2的大小。
反应的文字表达式:
$铁(Fe) + 硫酸铜(CuSO _ {4}){ → } 铜(Cu) + 硫酸亚铁(FeSO _ {4})$
实验现象:铁钉表面覆盖了一层红色的物质,锥形瓶中液体的颜色由蓝色逐渐变成浅绿色;铁钉和硫酸铜反应前后的质量m1=m2。
实验结论:参加化学反应的铁和硫酸铜的质量总和,等于反应后生成的铜和硫酸亚铁的质量总和。
注意:
1.(1)锥形瓶底部铺一层细沙的目的是防止锥形瓶底因受热不均而炸裂。
(2)在锥形瓶口的橡胶塞上安装一根玻璃管,在其上端系牢一个小气球,目的是防止红磷燃烧产生的热量使瓶内气体迅速膨胀而冲开橡胶塞。
(3)玻璃管下端与红磷接触的目的是引燃红磷,玻璃管还能起到导气的作用。
(4)此实验成功的关键是装置气密性要良好。第二次称量时,必须等到装置冷却,气球变瘪。
2.使用托盘天平时应特别注意:
(1)称量干燥的固体药品前,应在两个托盘各放一张干净的大小相同的纸片,然后把药品放在纸片上称量;
(2)易潮解或有腐蚀性的药品,必须放在玻璃器皿(如小烧杯、表面皿)里称量。