- 身边的化学物质身边的化学物质
- 空气和氧气空气和氧气
- 空气的成分空气的成分
- 氧气的性质和用途氧气的性质和用途
- 氧气的制取氧气的制取
- 水和氢气水和氢气
- 自然界的水自然界的水
- 氢气的性质及制取氢气的性质及制取
- 碳和碳的化合物碳和碳的化合物
- 碳单质碳单质
- 一氧化碳和二氧化碳一氧化碳和二氧化碳
- 二氧化碳的实验室制法二氧化碳的实验室制法
- 金属与金属材料金属与金属材料
- 金属材料金属材料
- 金属的化学性质金属的化学性质
- 金属资源的利用与保护金属资源的利用与保护
- 生活中常见的化合物生活中常见的化合物
- 常见的酸和碱常见的酸和碱
- 中和反应 pH中和反应 pH
- 常见的盐常见的盐
- 复分解反应复分解反应
- 化学肥料化学肥料
- 物质构成和变化物质构成和变化
- 物质的分类物质的分类
- 物质的微粒性物质的微粒性
- 分子分子
- 原子原子
- 离子离子
- 元素元素
- 物质组成的表示物质组成的表示
- 相对原子质量相对原子质量
- 相对分子质量相对分子质量
- 化学式化学式
- 化合价化合价
- 化学方程式化学方程式
- 物质变化物质变化
- 物理变化与化学变化物理变化与化学变化
- 化学反应类型化学反应类型
- 质量守恒定律质量守恒定律
- 金属活动性顺序金属活动性顺序
- 溶液溶液
- 化学基本实验与科学探究化学基本实验与科学探究
- 常用化学仪器常用化学仪器
- 化学实验基本操作化学实验基本操作
- 常见气体的实验室制取常见气体的实验室制取
- 物质鉴别物质鉴别
- 粗盐提纯粗盐提纯
- 粗盐提纯粗盐提纯
- 配制溶质质量分数一定的溶液配制溶质质量分数一定的溶液
- 化学计算化学计算
- 有关化学式的计算有关化学式的计算
- 有关化学方程式的计算有关化学方程式的计算
- 有关溶液的计算有关溶液的计算
- 综合计算综合计算
- 化学与社会发展化学与社会发展
- 人类重要的营养物质人类重要的营养物质
- 化学元素与人类健康化学元素与人类健康
- 有机合成材料有机合成材料
- 化学与能源化学与能源
- 燃烧与灭火燃烧与灭火
- 化石燃料化石燃料
- 能源的利用与开发能源的利用与开发
《质量守恒定律》真题练习
1单选题
用如图所示装置验证质量守恒定律,能达到实验目的的物质组合是( )
题目答案
您的答案
答案解析
问题要点
质量守恒定律是化学变化所遵循的普遍规律,在进行验验证时,应注意两点:
①药品能发生化学反应;
②应分别称量反应前后的所有反应物、生成物的质量,故有气体参加或产物会逸散的反应,必须在密闭容器中进行。
答案解析
双氧水在二氧化锰催化作用下分解生成氧气,氧气从烧杯中逸出,故反应后天平不平衡,选项1-错误;碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,二氧化碳气体会逸出,故反应后天平不平衡,选项2-错误;铁和硫酸铜反应生成硫酸亚铁和铜,化学反应前后的各物质均在烧杯中,故反应后天平平衡,能验证质量守恒定律,选项3-正确;氯化钠和水不能发生化学反应,故不能验证化学变化所遵循的质量守恒定律,选项4-错误。
2单选题
某纯净物在9.6g氧气中恰好完全燃烧,生成8.8gCO2和5.4gH2O,下列说法正确的是()
题目答案
您的答案
答案解析
问题要点
考查质量守恒定律的应用。解答此类问题先根据反应前后元素种类不变,推断出物质中一定含有或可能含有的元素,再根据元素质量不变求出一定含有的元素的质量,与物质质量比较大小确定出可能含有的元素质量;根据元素质量与相对原子质量的比值可求出原子个数比从而确定出物质的化学式(或最简式),根据物质质量与相对分子质量的比值可求出分子个数比。
答案解析
由质量守恒定律可知,反应前后元素种类不变,该物质中一定含有碳元素和氧元素。8.8gCO2中含有氧元素的质量为$8.8 g \times ( \frac {16 \times 2} {44} \times 100 \% ) = 6.4 g$,5.4gH2O中含有氧元素的质量为$5.4 g \times ( \frac {16} {18} \times 100 \% ) = 4.8 g$,生成物8.8g二氧化碳和5.4g水中所含氧元素的质量之和为6.4g+4.8g=11.2g,11.2g>9.6g;该物质中含氧元素的质量为11.2g-9.6g=1.6g,则该物质中一定含有碳、氢、氧三种元素。
3阅读解答
质量守恒定律对科学发展具有重大意义。小红、小刚和小涛以“化学反应一定遵守质量守恒定律”为课题进行科学探究,请填写以下探究过程中的空格:
题目答案
您的答案
答案解析
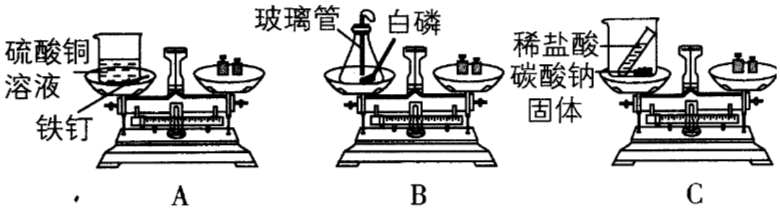
三位同学用如图所示的3个实验验证质量守恒定律,其中不能达到实验目的的是_____(填序号),理由是_____。
题目答案
C
反应生成的二氧化碳气体逸散,使天平不能保持平衡
您的答案
答案解析
C实验不能验证质量守恒定律,因为碳酸钠和盐酸反应会产生大量的二氧化碳气体,二氧化碳逸出,使得反应后测得剩余物质的质量变小。
小红选择A图实验,实验中观察到铁钉表面有出现,证明铁钉与硫酸铜溶液发生了化学变化;小刚选择B图所示的实验,实验中在锥形瓶里放少量白沙的原因是,如果小刚去掉小气球并将玻璃管换成玻璃棒,可能造成的不良后果是;小涛选择C图所示实验,图中他在天平右边添加砝码的正确顺序是(填“随便”“由大到小”或“由小到大”)。
题目答案
您的答案
答案解析
A实验中,铁和硫酸铜反应生成硫酸亚铁和铜,观察到铁钉表面有红色固体产生,溶液由蓝色变为浅绿色;B实验中白沙的作用是防止燃烧产生的热量使锥形瓶底部因受热不均而炸裂,小气球的作用是平衡压强,防止燃烧时气体受热膨胀将瓶塞冲开;使用天平时,添加砝码的正确顺序是由大到小。
结论分析。请从微观的角度,简要分析你认为任何化学变化都遵守质量守恒定律的原因:_____。
题目答案
任何化学变化反应前后原子的种类、数目、质量都不变
您的答案
答案解析
质量守恒定律的微观解释:化学变化前后原子的种类、数目、质量都不变。
4单选题
下列叙述中符合质量守恒定律的是 ( )