- 身边的化学物质身边的化学物质
- 空气和氧气空气和氧气
- 空气的成分空气的成分
- 氧气的性质和用途氧气的性质和用途
- 氧气的制取氧气的制取
- 水和氢气水和氢气
- 自然界的水自然界的水
- 氢气的性质及制取氢气的性质及制取
- 碳和碳的化合物碳和碳的化合物
- 碳单质碳单质
- 一氧化碳和二氧化碳一氧化碳和二氧化碳
- 二氧化碳的实验室制法二氧化碳的实验室制法
- 金属与金属材料金属与金属材料
- 金属材料金属材料
- 金属的化学性质金属的化学性质
- 金属资源的利用与保护金属资源的利用与保护
- 生活中常见的化合物生活中常见的化合物
- 常见的酸和碱常见的酸和碱
- 中和反应 pH中和反应 pH
- 常见的盐常见的盐
- 复分解反应复分解反应
- 化学肥料化学肥料
- 物质构成和变化物质构成和变化
- 物质的分类物质的分类
- 物质的微粒性物质的微粒性
- 分子分子
- 原子原子
- 离子离子
- 元素元素
- 物质组成的表示物质组成的表示
- 相对原子质量相对原子质量
- 相对分子质量相对分子质量
- 化学式化学式
- 化合价化合价
- 化学方程式化学方程式
- 物质变化物质变化
- 物理变化与化学变化物理变化与化学变化
- 化学反应类型化学反应类型
- 质量守恒定律质量守恒定律
- 金属活动性顺序金属活动性顺序
- 溶液溶液
- 化学基本实验与科学探究化学基本实验与科学探究
- 常用化学仪器常用化学仪器
- 化学实验基本操作化学实验基本操作
- 常见气体的实验室制取常见气体的实验室制取
- 物质鉴别物质鉴别
- 粗盐提纯粗盐提纯
- 粗盐提纯粗盐提纯
- 配制溶质质量分数一定的溶液配制溶质质量分数一定的溶液
- 化学计算化学计算
- 有关化学式的计算有关化学式的计算
- 有关化学方程式的计算有关化学方程式的计算
- 有关溶液的计算有关溶液的计算
- 综合计算综合计算
- 化学与社会发展化学与社会发展
- 人类重要的营养物质人类重要的营养物质
- 化学元素与人类健康化学元素与人类健康
- 有机合成材料有机合成材料
- 化学与能源化学与能源
- 燃烧与灭火燃烧与灭火
- 化石燃料化石燃料
- 能源的利用与开发能源的利用与开发
《有关溶液的计算》真题练习
1填空题
现有80g质量分数为10%的硝酸钠溶液,试回答下列问题:[br](1)上述硝酸钠溶液中含溶质的质量为g,溶剂的质量为g;[br](2)若向上述溶液中加入20g水,则溶液中溶质质量分数为%;[br](3)若向上述溶液中加入20g硝酸钠,全部溶解后溶液中溶质的质量分数为%;[br](4)若使上述溶液中溶质的质量分数变为5%,则应加水g。
题目答案
您的答案
答案解析
分析:
解答:
点评:
[br]本题难度不大,掌握溶质质量分数的有关计算、溶液稀释前后溶质的质量不变是正确解答本题的关键所在。
2单选题
将200克溶质质量分数为10%的蔗糖溶液稀释到5%,需加水的质量为( )
题目答案
您的答案
答案解析
分析:
溶液在加水稀释的过程中溶质的质量不变,加入的水的质量就是稀浓溶液质量之差.
解答:
解:由于溶液在加水的过程中溶质的质量不变,因此需加水的质量为:200g×105-200g=200g,故选D.
点评:
本题难度不是很大,主要考查了有关溶质质量分数的简单计算,培养学生的分析问题和计算能力.
3阅读解答
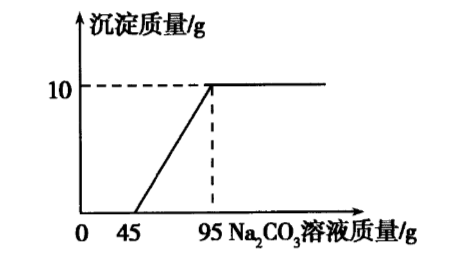
向$CaCl _ {2}$和$HCl$的混合溶液中逐滴加入$Na _ {2} CO _ {3}$溶液,生成沉淀的质量变化与加入$Na _ {2} CO _ {3}$溶液质量的关系如图所示;请回答问题:
题目答案
您的答案
答案解析
生成沉淀的质量为
题目答案
您的答案
答案解析
加入的碳酸钠先与盐酸反应,把盐酸消耗完,才与氯化钙反应生成沉淀。结合函数图像可知,完全反应生成沉淀的质量为10g。
求所用$Na _ {2} CO _ {3}$溶液的溶质质量分数。(计算结果保留一位小数)
题目答案
由题图可知,与$CaCl _ {2}$溶液反应的$Na _ {2} CO _ {3}$溶液的质量为$95 g - 45 g = 50 g$。
设$Na _ {2} CO _ {3}$溶液的溶质质量分数为x

答:所用$Na _ {2} CO _ {3}$溶液的溶质质量分数为$21.2 \%$。
您的答案
答案解析
根据沉淀的质量结合化学方程式可计算出碳酸钠溶液的溶质质量分数。
4填空题
图是实验室配制一定溶质质量分数的$NaCl$溶液的流程图。
 (1)应称量g$NaCl$,需加水mL(水的密度为1g/mL)。
(1)应称量g$NaCl$,需加水mL(水的密度为1g/mL)。
(2)某同学按图所示步骤依次操作,其中操作错误的步骤造成配制的溶液的溶质质量分数10%(填“>”“<"”或“=”)。
(3)若称量$NaCl$固体时指针向右偏转,则应直到天平平衡。
(4)取上述正确配制的溶液10g加水稀释到g,可得到5%的$NaCl$溶液。
题目答案
您的答案
答案解析
(1)配制10%的氯化钠溶液50g,需氯化钠的质量为50gx10%=5g;需水的质量为50g-5g=45g,合45mL。
(2)用量筒量取水时,仰视读数,会造成实际量取的水的体积偏大,则溶质质量分数偏小。
(3)称量氯化钠固体时,先放好砝码和调好游码,然后向左边托盘添加氯化钠,若发现指针向右偏转,说明氯化钠的质量小于砝码和游码的质量和,故应继续向左盘添加氯化钠,直至天平平衡。
(4)设稀释后的溶液质量为x,根据溶液稀释前后溶质的质量不变,则$10 g \times 10 \% = x \times 5 \%$,解得x=20g。
5填空题
配制一定溶质质量分数的氯化钠溶液的过程如图所示:

(1)写出图中标号a仪器的名称。
(2)配制50g质量分数为15%的氯化钠溶液,所需氯化钠和水的质量分别为:氯化钠g,水g。
(3)称量氯化钠时,氯化钠应放在托盘天平的(填“左”或“右”)盘。
(4)溶解过程中玻璃棒的作用是。
(5)对配制的溶液进行检测发现溶质质量分数偏小,其原因可能有(填序号)。
A.称量时,药品与砝码放反了
B.量取水的体积时,仰视读数
C.装瓶时,有少量溶液酒出
(6)把50g质量分数为15%的氯化钠溶液稀释成5%的氯化钠溶液,需要水的质量是g。
题目答案
您的答案
答案解析
(1)由题图可知,标号a仪器的名称是量筒。
(2)配制50g质量分数为15%的氯化钠溶液,需要氯化钠的质量为$50 g \times 15 \% = 7.5 g$,水的质量为$50 g - 7.5 g = 42.5 g$。
(3)称量氯化钠时,氯化钠应放在托盘天平的左盘。
(4)溶解过程中玻璃棒的作用是揽拌,加快溶解的速率。
(5)称量时,药品与砝码放反了且使用了游码,所称取的氯化钠的质量偏少,会使溶质质量分数偏小;量取水的体积时,仰视读数,实际量取的水偏多,会使溶质质量分数偏小;装瓶时,有少量溶液洒出,不会影响溶质的质量分数。
(6)设需要水的质量是x,根据稀释前后溶质的质量不变,可得$50 g \times 15 \% = ( 50 g +$$x ) \times 5 \%$,解得x=100g。