- 第八单元 金属和金属材料第八单元 金属和金属材料
- 课题1 金属材料课题1 金属材料
- 几种重要的金属几种重要的金属
- 合金合金
- 课题2 金属的化学性质课题2 金属的化学性质
- 金属与氧气的反应金属与氧气的反应
- 金属与盐酸、稀硫酸的反应金属与盐酸、稀硫酸的反应
- 置换反应置换反应
- 金属与其他金属化合物溶液的反应金属与其他金属化合物溶液的反应
- 金属活动性顺序金属活动性顺序
- 课题3 金属资源的利用和保护课题3 金属资源的利用和保护
- 金属资源的存在形式及常见的矿石金属资源的存在形式及常见的矿石
- 铁的冶炼铁的冶炼
- 有关化学反应中杂质问题的计算有关化学反应中杂质问题的计算
- 金属资源保护金属资源保护
- 实验活动4 金属的物理性质和某些化学性质实验活动4 金属的物理性质和某些化学性质
- 第九单元 溶液第九单元 溶液
- 课题1 溶液的形成课题1 溶液的形成
- 溶液溶液
- 溶解时的吸热或放热现象溶解时的吸热或放热现象
- 乳化现象乳化现象
- 课题2 溶解度课题2 溶解度
- 饱和溶液饱和溶液
- 固体溶解度固体溶解度
- 气体溶解度气体溶解度
- 课题3 溶液的浓度课题3 溶液的浓度
- 溶质质量分数溶质质量分数
- 溶液的计算溶液的计算
- 溶液的配制溶液的配制
- 实验活动5 一定溶质质量分数的氯化钠溶液的配制实验活动5 一定溶质质量分数的氯化钠溶液的配制
- 第十单元 酸和碱第十单元 酸和碱
- 课题1 常见的酸和碱课题1 常见的酸和碱
- 酸、碱与指示剂作用酸、碱与指示剂作用
- 常见的酸常见的酸
- 常见的碱常见的碱
- 课题2 酸和碱的中和反应课题2 酸和碱的中和反应
- 中和反应中和反应
- 中和反应在实际中的应用中和反应在实际中的应用
- 溶液酸碱度的表示法——pH溶液酸碱度的表示法——pH
- 了解溶液酸碱性的重要意义了解溶液酸碱性的重要意义
- 实验活动6 酸、碱的化学性质实验活动6 酸、碱的化学性质
- 实验活动7 溶液酸碱性的检验实验活动7 溶液酸碱性的检验
- 第十一单元 盐 化肥第十一单元 盐 化肥
- 课题1 生活中常见的盐课题1 生活中常见的盐
- 氯化钠氯化钠
- 粗盐提纯粗盐提纯
- 碳酸钠、碳酸氢钠和碳酸钙碳酸钠、碳酸氢钠和碳酸钙
- 复分解反应复分解反应
- 盐的化学性质盐的化学性质
- 课题2 化学肥料课题2 化学肥料
- 常见化肥的种类和作用常见化肥的种类和作用
- 使用化肥、农药与环境的关系使用化肥、农药与环境的关系
- 化肥的简易鉴别化肥的简易鉴别
- 实验活动8 粗盐中难溶性杂质的去除实验活动8 粗盐中难溶性杂质的去除
- 第十二单元 化学与生活第十二单元 化学与生活
- 课题1 人类重要的营养物质课题1 人类重要的营养物质
- 课题2 化学元素与人体健康课题2 化学元素与人体健康
- 课题3 有机合成材料课题3 有机合成材料
《铁的冶炼》考点精粹
铁的冶炼
1.一氧化碳还原氧化铁
实验药品 | 氧化铁粉末、澄清石灰水、一氧化碳气体 |
实验仪器 | 铁架台、硬质玻璃管、单孔橡皮塞、酒精灯、试管、酒精喷灯、双孔橡皮塞、导气管 |
实验装置 | 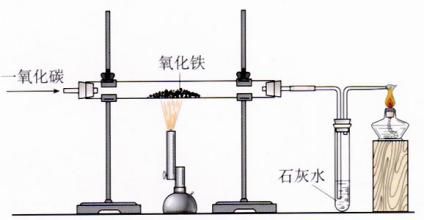 |
实验步骤 | ①检查装置气密性;②装入药品并固定装置; ③点燃酒精灯;④向玻璃管中通人CO; ⑤点燃酒精喷灯;⑥反应完成后熄灭酒精喷灯; ⑦试管冷却后停止通入CO;⑧熄灭酒精灯 |
实验现象 | ①红棕色粉末逐渐变为黑色,黑色粉末能被磁铁吸引; ②生成的气体使试管中的澄清石灰水变浑浊; ③尾气燃烧并产生蓝色火焰 |
化学方程式 | 酒精喷灯处:$3CO + 2Fe_ {2}O_ {3} \stackrel {高温} {=} 4Fe + 3CO _ {2}$↑ 试管中:$ Ca(OH)_ {2} + CO_{2} \stackrel {} {=} CaCO_ {3}$↓$+ H_ {2}O $ 酒精灯处:$ 2CO + O_ {2} \stackrel {点燃} {=} 2CO_ {2} $ |
实验结论 | 红棕色的氧化铁被一氧化碳还原成单质铁 |
注意事项 | ①先通CO的目的:排出装置内的空气,以免加热时CO与空气混合,可能会发生爆炸 ②实验完毕后继续通入CO直到玻璃管冷却的目的:防止生成的铁粉在较高的温度下被重新氧化;防止石灰水倒流使玻璃管炸裂 ③尾气的处理:因为CO有毒,所以尾气中的CO要经过点燃处理或收集备用,防止污染空气 |
2.工业炼铁
主要设备 | 高炉 |
原料 | 铁矿石、焦炭、石灰石、空气等 |
反应原理 | 在高温的条件下,利用炉内反应生成的一氧化碳把铁从铁矿石中还原出来 |
化学方程式 | 以赤铁矿为原料,主要反应为 $3CO + 2Fe_ {2}O_ {3} \stackrel {高温} {=} 4Fe + 3CO _ {2}$↑ 以磁铁矿为原料,主要反应为$4CO + Fe_ {3}O_ {4} \stackrel {高温} {=} 3Fe + 4CO _ {2}$↑ 焦炭的作用: (1)提供热量:$ C+ O_ {2} \stackrel {点燃} {=} CO_ {2} $ (2)提供还原剂:$ CO_ {2} + C \stackrel {高温} {=} 2CO $ 炼铁过程中石灰石的主要作用是将矿石中的二氧化硅转变为炉渣除去 |
产品 | 生铁(含碳量为2%~4.3%的铁合金,不是纯铁) |
拓展
(1)炼铁的主要原料是铁矿石等,主要产品是生铁;炼钢的主要原料是生铁等,主要产品是钢。
(2)石灰石的主要作用是将矿石中的二氧化硅变为炉渣,其主要反应有:
①产生CaO:$ CaCO_ {3} \stackrel {高温} {=} CaO + CO_ {2} $↑ 。
②生成炉渣:$ CaO + SiO_ {2} \stackrel {高温} {=} CaSiO_ {3} $ 。
(3)将生铁冶炼成钢主要是将生铁中的碳转变为气体除去,“百炼成钢”的主要反应为$ C+ O_ {2} \stackrel {高温} {=} CO_ {2} $。
(4)古籍中曾有记载:“曾青得铁则化为铜”,其中涉及的化学反应为$ Fe + CuSO_ {4} \stackrel {} {=} Fe_ {}SO_ {4} + Cu $,这是古代湿法炼铜的原理。