- 第八单元 金属和金属材料第八单元 金属和金属材料
- 课题1 金属材料课题1 金属材料
- 几种重要的金属几种重要的金属
- 合金合金
- 课题2 金属的化学性质课题2 金属的化学性质
- 金属与氧气的反应金属与氧气的反应
- 金属与盐酸、稀硫酸的反应金属与盐酸、稀硫酸的反应
- 置换反应置换反应
- 金属与其他金属化合物溶液的反应金属与其他金属化合物溶液的反应
- 金属活动性顺序金属活动性顺序
- 课题3 金属资源的利用和保护课题3 金属资源的利用和保护
- 金属资源的存在形式及常见的矿石金属资源的存在形式及常见的矿石
- 铁的冶炼铁的冶炼
- 有关化学反应中杂质问题的计算有关化学反应中杂质问题的计算
- 金属资源保护金属资源保护
- 实验活动4 金属的物理性质和某些化学性质实验活动4 金属的物理性质和某些化学性质
- 第九单元 溶液第九单元 溶液
- 课题1 溶液的形成课题1 溶液的形成
- 溶液溶液
- 溶解时的吸热或放热现象溶解时的吸热或放热现象
- 乳化现象乳化现象
- 课题2 溶解度课题2 溶解度
- 饱和溶液饱和溶液
- 固体溶解度固体溶解度
- 气体溶解度气体溶解度
- 课题3 溶液的浓度课题3 溶液的浓度
- 溶质质量分数溶质质量分数
- 溶液的计算溶液的计算
- 溶液的配制溶液的配制
- 实验活动5 一定溶质质量分数的氯化钠溶液的配制实验活动5 一定溶质质量分数的氯化钠溶液的配制
- 第十单元 酸和碱第十单元 酸和碱
- 课题1 常见的酸和碱课题1 常见的酸和碱
- 酸、碱与指示剂作用酸、碱与指示剂作用
- 常见的酸常见的酸
- 常见的碱常见的碱
- 课题2 酸和碱的中和反应课题2 酸和碱的中和反应
- 中和反应中和反应
- 中和反应在实际中的应用中和反应在实际中的应用
- 溶液酸碱度的表示法——pH溶液酸碱度的表示法——pH
- 了解溶液酸碱性的重要意义了解溶液酸碱性的重要意义
- 实验活动6 酸、碱的化学性质实验活动6 酸、碱的化学性质
- 实验活动7 溶液酸碱性的检验实验活动7 溶液酸碱性的检验
- 第十一单元 盐 化肥第十一单元 盐 化肥
- 课题1 生活中常见的盐课题1 生活中常见的盐
- 氯化钠氯化钠
- 粗盐提纯粗盐提纯
- 碳酸钠、碳酸氢钠和碳酸钙碳酸钠、碳酸氢钠和碳酸钙
- 复分解反应复分解反应
- 盐的化学性质盐的化学性质
- 课题2 化学肥料课题2 化学肥料
- 常见化肥的种类和作用常见化肥的种类和作用
- 使用化肥、农药与环境的关系使用化肥、农药与环境的关系
- 化肥的简易鉴别化肥的简易鉴别
- 实验活动8 粗盐中难溶性杂质的去除实验活动8 粗盐中难溶性杂质的去除
- 第十二单元 化学与生活第十二单元 化学与生活
- 课题1 人类重要的营养物质课题1 人类重要的营养物质
- 课题2 化学元素与人体健康课题2 化学元素与人体健康
- 课题3 有机合成材料课题3 有机合成材料
《中和反应》考点精粹
中和反应
1.概念:
酸与碱作用生成盐和水的反应,叫做中和反应。
2.表达式:
酸+碱→盐+水
例如:$ HCl +NaOH \stackrel {} {=} NaCl + H_ {2}O $
$ H_ {2}SO_ {4} +2NaOH \stackrel {} {=} Na_ {2}SO_ {4} + 2H_ {2}O $
$ HCl +KOH \stackrel {} {=} KCl + H_ {2}O $
注意:
(1)酸碱中和反应生成盐和水,但是有盐和水生成的反应不一定是中和反应。
如反应$ 2Na(OH)_ {2} + CO_ {2} \stackrel {} {=} Na_ {2}CO_ {3} + H_ {2}O $ 。
(2)并不是所有的中和反应都没有明显现象,
如$ H_ {2}SO_ {4}+Cu(OH)_ {2} \stackrel {} {=} CuSO_ {4}+ 2H_ {2}O $溶液由无色变成蓝色。
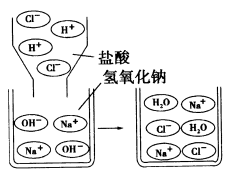
3.中和反应的实质
①盐酸、硫酸等酸溶液中都可以解离出氢离子和酸根离子,
酸具有相似的化学性质的原因是酸溶液中都含有$H^{+}$。
②氢氧化钠、氢氧化钙等碱溶液中都能解离出自由移动的金属离子(或$NH_{4}^{+}$)和$OH^{-}$。
碱溶液中都含有$OH^{-}$,所以碱溶液也具有相似的化学性质。
③中和反应的实质就是酸溶液中的$H^{+}$与碱溶液中的$OH^{-}$结合生成水分子的过程。
如$ HCl +NaOH \stackrel {} {=} NaCl + H_ {2}O $中,实际参加反应的是$H^{+}$和$OH^{-}$,即$H^{+}+OH^{-}=H_{2}O$(如图所示),溶液中$Na^{+}$和$Cl^{-}$的个数不变。