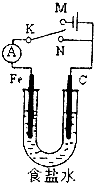
下列关于金属腐蚀的叙述不正确的是( )
题目答案
您的答案
答案解析
分析:
A.铜锌合金在电解质溶液中形成原电池反应,依据原电池电极反应分析判断;
B.不纯的金属易发生电化学腐蚀;
C.金属的吸氧腐蚀和析氢腐蚀过程中均形成原电池;
D.金属腐蚀的本质是金属原子失电子.
解答:
解:A.铜锌合金在电解质溶液中形成原电池反应,锌做负极被腐蚀.正极被保护,所以不易形成铜绿;和电化学有关,故A正确;
B.不纯的金属易发生电化学腐蚀,纯金属主要发生化学腐蚀,电化学腐蚀的速率大于化学腐蚀,所以生铁更容易被腐蚀,故B错误;
C.金属的吸氧腐蚀和析氢腐蚀过程中均形成原电池,则金属的吸氧腐蚀和析氢腐蚀都属于电化学腐蚀,故C正确;
D.金属腐蚀的本质是金属原子失电子,即金属腐蚀的本质是M-ne‑=M_,故D正确.
故选B.
点评:
本题考查金属的腐蚀,注意在原电池中,负极金属易被腐蚀,正极金属被保护,明确化学腐蚀和电化学腐蚀的区别即可解答,题目难度不大.