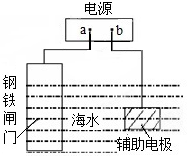
在H$_2$O+CH$_3$COO_⇌CH$_3$COOH+OH_的平衡中,要使水解平衡向右移动,应采取的措施是( )
题目答案
您的答案
答案解析
分析:
在H$_2$O+CH$_3$COO_⇌CH$_3$COOH+OH_的平衡中,要使水解平衡向右移动,反应是吸热过程,依据平衡移动原理可以利用升高温度或加入酸促进水解.
解答:
解:在H$_2$O+CH$_3$COO_⇌CH$_3$COOH+OH_的平衡中,要使水解平衡向右移动,反应是吸热过程,
A、加入氢氧化钠固体,溶解后氢氧根离子浓度增大,平衡逆向进行,故A错误;
B、加入冰醋酸电离大于水解,醋酸分子浓度增大程度大,水解程度减小,故B错误;
C、反应体系是溶液中的反应,增大压强对平衡无影响,故C错误;
D、水解是吸热过程,升温促进水解正向进行,故D正确;
故选D.
点评:
本题考查了平衡移动原理的分析判断,注意平衡特征分析,掌握基础是关键,题目较简单.
 (多选)氯原子对O$_3$分解有催化作用:Cl+O$_3$=ClO+O$_2$ △H$_1$;ClO+O=Cl+O$_2$ △H$_2$大气臭氧层的分解反应是:O+O$_3$=2O$_2$ △H,该反应的能量变化示意图如图所示:下列叙述中,正确的是( )
(多选)氯原子对O$_3$分解有催化作用:Cl+O$_3$=ClO+O$_2$ △H$_1$;ClO+O=Cl+O$_2$ △H$_2$大气臭氧层的分解反应是:O+O$_3$=2O$_2$ △H,该反应的能量变化示意图如图所示:下列叙述中,正确的是( )