- 化学使世界变得更加绚丽多彩化学使世界变得更加绚丽多彩
- 什么是化学什么是化学
- 化学发展史化学发展史
- 走进化学世界走进化学世界
- 化学变化和物理变化化学变化和物理变化
- 化学性质和物理性质化学性质和物理性质
- 对蜡烛及其燃烧的探究对蜡烛及其燃烧的探究
- 对人体吸入的空气和呼出的气体的探究对人体吸入的空气和呼出的气体的探究
- 简单仪器简单仪器
- 药品的取用药品的取用
- 天平的使用天平的使用
- 量筒的使用量筒的使用
- 酒精灯的使用酒精灯的使用
- 连接仪器装置连接仪器装置
- 玻璃仪器洗干净的标准玻璃仪器洗干净的标准
- 我们周围的空气我们周围的空气
- 空气中氧气含量的测定实验空气中氧气含量的测定实验
- 空气成分空气成分
- 纯净物混合物的分类纯净物混合物的分类
- 空气中氮气和稀有气体的用途空气中氮气和稀有气体的用途
- 空气污染及防治空气污染及防治
- 氧气氧气
- 氧气的物理性质氧气的物理性质
- 木炭燃烧木炭燃烧
- 硫燃烧硫燃烧
- 铁燃烧铁燃烧
- 氧气的化学性质和用途氧气的化学性质和用途
- 氧化反应氧化反应
- 化合反应与氧化反应化合反应与氧化反应
- 加热高锰酸钾制氧气加热高锰酸钾制氧气
- 过氧化氢溶液制氧气过氧化氢溶液制氧气
- 氧气的收集、验满与检验氧气的收集、验满与检验
- 气体制取装置的选择气体制取装置的选择
- 催化剂催化剂
- 分解反应分解反应
- 氧气的工业制法氧气的工业制法
- 物质构成的奥秘物质构成的奥秘
- 物质的构成及分子的特征物质的构成及分子的特征
- 探究分子运动实验探究分子运动实验
- 分子分子
- 用分子的观点解释物质的组成用分子的观点解释物质的组成
- 用分子的观点解释物质的变化用分子的观点解释物质的变化
- 分子与原子的区别与联系分子与原子的区别与联系
- 原子的构成原子的构成
- 原子核外电子的排布原子核外电子的排布
- 原子结构示意图原子结构示意图
- 原子结构与原子化学性质的关系原子结构与原子化学性质的关系
- 离子的定义及分类离子的定义及分类
- 离子符号的写法与意义离子符号的写法与意义
- 相对原子质量相对原子质量
- 相对原子质量、质子数、中子数之间的关系相对原子质量、质子数、中子数之间的关系
- 元素的定义元素的定义
- 地壳中元素的含量地壳中元素的含量
- 元素符号的写法及意义元素符号的写法及意义
- 元素周期表简介及元素周期表提供的信息元素周期表简介及元素周期表提供的信息
- 自然界的水自然界的水
- 爱护水资源爱护水资源
- 自来水净化自来水净化
- 过滤过滤
- 硬水和软水硬水和软水
- 氢气的性质与检验氢气的性质与检验
- 水的组成实验水的组成实验
- 纯净物的分类――单质、化合物、氧化物纯净物的分类――单质、化合物、氧化物
- 化学式的意义化学式的意义
- 化学式的读写化学式的读写
- 化合价化合价
- 化合价的应用化合价的应用
- 原子团原子团
- 化学符号及周边数字的意义化学符号及周边数字的意义
- 有关相对分子质量的计算有关相对分子质量的计算
- 化学方程式化学方程式
- 化学反应前后物质的质量关系的实验探究化学反应前后物质的质量关系的实验探究
- 质量守恒定律质量守恒定律
- 实验探究质量守恒定律时应注意的问题实验探究质量守恒定律时应注意的问题
- 质量守恒定律的微观解释质量守恒定律的微观解释
- 质量守恒定律的相关计算质量守恒定律的相关计算
- 化学方程式化学方程式
- 化学方程式的书写原则与步骤化学方程式的书写原则与步骤
- 化学方程式的配平方法化学方程式的配平方法
- 化学方程式的简单计算化学方程式的简单计算
- 碳和碳的氧化物碳和碳的氧化物
- 碳的几种单质碳的几种单质
- 常温下化学性质稳定常温下化学性质稳定
- 碳与氧气的反应——可燃性碳与氧气的反应——可燃性
- 碳与某些氧化物的反应——还原性碳与某些氧化物的反应——还原性
- 二氧化碳的实验室制法二氧化碳的实验室制法
- 二氧化碳的实验室制法原料的选择二氧化碳的实验室制法原料的选择
- 二氧化碳的物理性质二氧化碳的物理性质
- 二氧化碳的化学性质--与水的反应二氧化碳的化学性质--与水的反应
- 二氧化碳的化学性质--与澄清石灰水的反应二氧化碳的化学性质--与澄清石灰水的反应
- 二氧化碳的用途及危害二氧化碳的用途及危害
- 一氧化碳的物理性质和毒性一氧化碳的物理性质和毒性
- 一氧化碳的化学性质--可燃性一氧化碳的化学性质--可燃性
- 一氧化碳的化学性质--还原性一氧化碳的化学性质--还原性
- 碳及其化合物的相互转化关系碳及其化合物的相互转化关系
- 燃料及其利用燃料及其利用
- 燃烧和燃烧的条件燃烧和燃烧的条件
- 探究燃烧的条件探究燃烧的条件
- 灭火的原理和方法灭火的原理和方法
- 灭火器灭火器
- 易燃物和易爆物的安全知识易燃物和易爆物的安全知识
- 化学反应中的能量变化化学反应中的能量变化
- 煤和石油煤和石油
- 天然气天然气
- 合理利用与开发化石能源合理利用与开发化石能源
- 使用燃料对环境的影响使用燃料对环境的影响
- 能源的利用与开发能源的利用与开发
- 金属和金属材料金属和金属材料
- 几种重要的金属几种重要的金属
- 合金合金
- 金属与氧气的反应金属与氧气的反应
- 探究金属与盐酸、稀硫酸的反应探究金属与盐酸、稀硫酸的反应
- 金属与盐酸、稀硫酸的反应金属与盐酸、稀硫酸的反应
- 金属与酸反应-图象问题(一)金属与酸反应-图象问题(一)
- 金属与酸反应-图象问题(二)金属与酸反应-图象问题(二)
- 金属与酸反应-天平问题金属与酸反应-天平问题
- 金属与酸反应-混合物计算金属与酸反应-混合物计算
- 置换反应置换反应
- 探究金属活动性顺序探究金属活动性顺序
- 金属活动性顺序及其应用金属活动性顺序及其应用
- 选择试剂验证金属的活动性顺序选择试剂验证金属的活动性顺序
- 金属质量变化的判断金属质量变化的判断
- 滤液与滤渣滤液与滤渣
- 金属流程金属流程
- 金属资源的利用和保护金属资源的利用和保护
- 金属在自然界中的存在金属在自然界中的存在
- 工业炼铁工业炼铁
- 一氧化碳还原氧化铁实验一氧化碳还原氧化铁实验
- 铁生锈条件的探究铁生锈条件的探究
- 金属资源保护金属资源保护
- 溶液溶液
- 溶液的形成、概念及特征溶液的形成、概念及特征
- 溶液的组成、命名及用途溶液的组成、命名及用途
- 溶解时的吸热或放热现象溶解时的吸热或放热现象
- 乳化现象乳化现象
- 饱和溶液和不饱和溶液饱和溶液和不饱和溶液
- 饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系
- 结晶结晶
- 固体溶解度固体溶解度
- 固体溶解度的表示方法固体溶解度的表示方法
- 固体溶解度曲线的应用固体溶解度曲线的应用
- 气体溶解度气体溶解度
- 溶质的质量分数溶质的质量分数
- 溶质质量分数和溶解度的区别和联系溶质质量分数和溶解度的区别和联系
- 溶液计算―直接计算溶液计算―直接计算
- 溶液计算―稀释、浓缩问题溶液计算―稀释、浓缩问题
- 溶液计算―与化学方程式的相关计算溶液计算―与化学方程式的相关计算
- 溶液的配制溶液的配制
- 酸和碱酸和碱
- 酸、碱与指示剂作用酸、碱与指示剂作用
- 几种常见的酸几种常见的酸
- 浓硫酸的腐蚀性浓硫酸的腐蚀性
- 浓硫酸的稀释浓硫酸的稀释
- 酸的化学性质酸的化学性质
- 酸与金属氧化物的应用酸与金属氧化物的应用
- 几种常见的碱--氢氧化钠几种常见的碱--氢氧化钠
- 几种常见的碱--氢氧化钙几种常见的碱--氢氧化钙
- 碱的化学性质碱的化学性质
- 酸、碱分别具有相似化学性质的原因酸、碱分别具有相似化学性质的原因
- 中和反应中和反应
- 中和反应在实际中的应用中和反应在实际中的应用
- 溶液酸碱度的表示法-pH溶液酸碱度的表示法-pH
- 中和反应的验证中和反应的验证
- 溶液pH变化问题溶液pH变化问题
- 盐、化肥盐、化肥
- 氯化钠氯化钠
- 粗盐中难溶性杂质的去除粗盐中难溶性杂质的去除
- 碳酸钙碳酸钙
- 碳酸钠碳酸钠
- 碳酸氢钠碳酸氢钠
- 碳酸根离子的检验碳酸根离子的检验
- 复分解反应复分解反应
- 常见化肥的种类和作用常见化肥的种类和作用
- 化肥的简易鉴别化肥的简易鉴别
- 氮肥的简单鉴别氮肥的简单鉴别
- 化学与生活化学与生活
- 蛋白质蛋白质
- 糖类糖类
- 油脂和维生素油脂和维生素
- 化学元素与人体健康化学元素与人体健康
- 有机化合物有机化合物
- 有机合成材料有机合成材料
《实验探究质量守恒定律时应注意的问题》实验探究质量守恒定律时应注意的问题
1单选题
下列实验能够直接用于验证质量守恒定律的是( )
题目答案
您的答案
答案解析
分析:
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和.
解答:
A、氯化钾和碳酸钠不能发生化学反应,因此不能用来验证质量守恒定律;
B、镁燃烧生成的氧化镁一部分扩散到空气中,因此不能直接用于验证质量守恒定律;
C、稀盐酸和碳酸钠反应生成的二氧化碳扩散到空气中,因此不能直接用于验证质量守恒定律;
D、氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,能够直接用于验证质量守恒定律.
故选:D.
点评:
化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础.
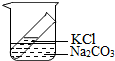
2单选题
甲、乙、丙三位同学用三个不同的实验来验证质量守恒定律如图.他们的方法是,先将下图装置分别放在天平上调节至平衡,然后分别取下,甲、乙将试管中的液体与锥形瓶中的物质混合,丙将气球中的镁粉倒入锥形瓶中充分反应后,再放入各自的天平上,下列结论你认为正确的是( )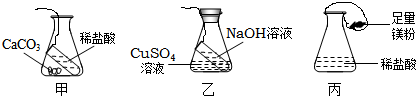
题目答案
您的答案
答案解析
分析:
做验证质量守恒定律的实验时,选用的药品和装置应该考虑到:①如果反应物中有气体参加反应,或生成物中有气体生成,应该选用密闭装置.②如果反应物中没有气体参加生成物中也没有气体生成,装置可不考虑密闭.
解答:
解:甲实验中碳酸钙和盐酸反应产生的二氧化碳气体跑掉了,反应后锥形瓶内物质的质量要小于反应前物质的质量,故天平不平衡;乙实验中,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠溶液,没有生成气体,反应后锥形瓶内物质质量不变,天平平衡;丙实验中,镁和稀硫酸反应生成氢气,生成的氢气被气球收集了起来,没有跑掉,在不考虑浮力的条件下,反应后物质的质量和反应前相等,天平平衡;
故选C
点评:
本题告诉我们在对质量守恒定律进行实验探究时,要选择密闭的装置或者在选择药品时要注意不要选择反应后有气体生成的药品.
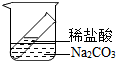
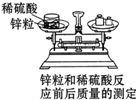
3单选题
下列验证质量守恒定律的实验中,能得出正确结论的是( )
题目答案
您的答案
答案解析
分析:
本题考查的是质量守恒定律,其内容是:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和.本题中的实验探究也应符合这一规律,如果用的药品相互反应生成的是沉淀和水,可以用烧杯等敞口容器;如果用的药品生成的是气体、或有气体加入或与空气中的其它成分反应,就必须用密闭的容器.
解答:
解:A、本选项用的是密闭的容器,反应前后天平平衡,故选项正确;
B、蜡烛和氧气反应生成二氧化碳和水,二氧化碳和水都跑到空气中去了,因此不可以,故选项错误;
C、镁条和氧气反应生成氧化镁,应该用密闭的容器,故选项错误;
D、锌和硫酸反应生成硫酸锌和氢气,应该用密闭的容器,故选项错误;
故选A
点评:
本考点是有关质量守恒定律的实验探究,有关质量守恒定律的考题在中考中经常出现,要抓住要点:五个一定不变,一个一定变.还要注意药品的选择和装置的选择,本考点经常出现在选择题、填空题和实验题中.
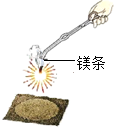
4单选题
某化学兴趣小组的同学用右图探究质量守恒定律,结果测得反应前后质量不相等.他们更换药品后重新实验,得出了正确的结论.他们选用的试剂是( )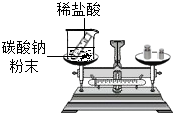
题目答案
您的答案
答案解析
分析:
对于质量守恒定律定律的理解与运用,在考虑物质的质量总和时,要把参加反应的气体或者生成的气体也得考虑到,这一点是我们容易错的地方,本题中是一个开放的环境,所以如果反应中有气体产生将会逸散到空气中,这样就会给我们造成质量不守恒的假象,所以在现有的条件下,要是想得出正确的结论,只能是用不会生成气体,也没有气体参与的反应来进行实验.
解答:
解:A、稀盐酸和镁条反应要生成氢气,而氢气要逸散到空气中,难以称量,故A错
B、碳酸钠要和稀硫酸反应生成二氧化碳气体,同样难以称得其质量,故B错
C、稀盐酸和铜粉不反应,也就谈不上质量守恒了,故C错
D、碳酸钠和氯化钙能够反应生成碳酸钙沉淀和氯化钠,没有气体产生,所以在现有的条件下能够得到正确的结论,故D对
故选D
点评:
在运用质量守恒定律来解决问题时,要注意参加反应和生成的物质的状态,特别是在有气体、白烟等反应中,不要仅仅根据我们看到的假象,就简单的认为质量不守恒,也就是说考虑问题要全面.
5单选题
根据质量守恒定律以及2Mg+O$_2$$\xlongequal[]{点燃}$2MgO的反应方程式,下列各组数据中正确的是( )
题目答案
您的答案
答案解析
分析:
根据题干信息可知,镁完全燃烧时,生成氧化镁.由它们反应的化学方程式各种物质的比例关系应用于质量守恒定律判断选项正误.
解答:
解:由化学方程式2Mg+O$_2$ $\xlongequal[]{点燃}$2MgO能够可知:每有48份质量的镁和32份质量的氧气在点燃的条件下完全化合生成80份质量的氧化镁.即参加反应的镁、氧气和生成的氧化镁质量之比=3:2:5
A、不符合各比例关系,故错误;
B、符合质量守恒定律;故正确
C、不符合各比例关系,故错误;
D、不符合各比例关系,故错误;
故选B
点评:
化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和即质量守恒定律.在这里要注意“参加反应”这四个字的含义.