- 化学使世界变得更加绚丽多彩化学使世界变得更加绚丽多彩
- 什么是化学什么是化学
- 化学发展史化学发展史
- 走进化学世界走进化学世界
- 化学变化和物理变化化学变化和物理变化
- 化学性质和物理性质化学性质和物理性质
- 对蜡烛及其燃烧的探究对蜡烛及其燃烧的探究
- 对人体吸入的空气和呼出的气体的探究对人体吸入的空气和呼出的气体的探究
- 简单仪器简单仪器
- 药品的取用药品的取用
- 天平的使用天平的使用
- 量筒的使用量筒的使用
- 酒精灯的使用酒精灯的使用
- 连接仪器装置连接仪器装置
- 玻璃仪器洗干净的标准玻璃仪器洗干净的标准
- 我们周围的空气我们周围的空气
- 空气中氧气含量的测定实验空气中氧气含量的测定实验
- 空气成分空气成分
- 纯净物混合物的分类纯净物混合物的分类
- 空气中氮气和稀有气体的用途空气中氮气和稀有气体的用途
- 空气污染及防治空气污染及防治
- 氧气氧气
- 氧气的物理性质氧气的物理性质
- 木炭燃烧木炭燃烧
- 硫燃烧硫燃烧
- 铁燃烧铁燃烧
- 氧气的化学性质和用途氧气的化学性质和用途
- 氧化反应氧化反应
- 化合反应与氧化反应化合反应与氧化反应
- 加热高锰酸钾制氧气加热高锰酸钾制氧气
- 过氧化氢溶液制氧气过氧化氢溶液制氧气
- 氧气的收集、验满与检验氧气的收集、验满与检验
- 气体制取装置的选择气体制取装置的选择
- 催化剂催化剂
- 分解反应分解反应
- 氧气的工业制法氧气的工业制法
- 物质构成的奥秘物质构成的奥秘
- 物质的构成及分子的特征物质的构成及分子的特征
- 探究分子运动实验探究分子运动实验
- 分子分子
- 用分子的观点解释物质的组成用分子的观点解释物质的组成
- 用分子的观点解释物质的变化用分子的观点解释物质的变化
- 分子与原子的区别与联系分子与原子的区别与联系
- 原子的构成原子的构成
- 原子核外电子的排布原子核外电子的排布
- 原子结构示意图原子结构示意图
- 原子结构与原子化学性质的关系原子结构与原子化学性质的关系
- 离子的定义及分类离子的定义及分类
- 离子符号的写法与意义离子符号的写法与意义
- 相对原子质量相对原子质量
- 相对原子质量、质子数、中子数之间的关系相对原子质量、质子数、中子数之间的关系
- 元素的定义元素的定义
- 地壳中元素的含量地壳中元素的含量
- 元素符号的写法及意义元素符号的写法及意义
- 元素周期表简介及元素周期表提供的信息元素周期表简介及元素周期表提供的信息
- 自然界的水自然界的水
- 爱护水资源爱护水资源
- 自来水净化自来水净化
- 过滤过滤
- 硬水和软水硬水和软水
- 氢气的性质与检验氢气的性质与检验
- 水的组成实验水的组成实验
- 纯净物的分类――单质、化合物、氧化物纯净物的分类――单质、化合物、氧化物
- 化学式的意义化学式的意义
- 化学式的读写化学式的读写
- 化合价化合价
- 化合价的应用化合价的应用
- 原子团原子团
- 化学符号及周边数字的意义化学符号及周边数字的意义
- 有关相对分子质量的计算有关相对分子质量的计算
- 化学方程式化学方程式
- 化学反应前后物质的质量关系的实验探究化学反应前后物质的质量关系的实验探究
- 质量守恒定律质量守恒定律
- 实验探究质量守恒定律时应注意的问题实验探究质量守恒定律时应注意的问题
- 质量守恒定律的微观解释质量守恒定律的微观解释
- 质量守恒定律的相关计算质量守恒定律的相关计算
- 化学方程式化学方程式
- 化学方程式的书写原则与步骤化学方程式的书写原则与步骤
- 化学方程式的配平方法化学方程式的配平方法
- 化学方程式的简单计算化学方程式的简单计算
- 碳和碳的氧化物碳和碳的氧化物
- 碳的几种单质碳的几种单质
- 常温下化学性质稳定常温下化学性质稳定
- 碳与氧气的反应——可燃性碳与氧气的反应——可燃性
- 碳与某些氧化物的反应——还原性碳与某些氧化物的反应——还原性
- 二氧化碳的实验室制法二氧化碳的实验室制法
- 二氧化碳的实验室制法原料的选择二氧化碳的实验室制法原料的选择
- 二氧化碳的物理性质二氧化碳的物理性质
- 二氧化碳的化学性质--与水的反应二氧化碳的化学性质--与水的反应
- 二氧化碳的化学性质--与澄清石灰水的反应二氧化碳的化学性质--与澄清石灰水的反应
- 二氧化碳的用途及危害二氧化碳的用途及危害
- 一氧化碳的物理性质和毒性一氧化碳的物理性质和毒性
- 一氧化碳的化学性质--可燃性一氧化碳的化学性质--可燃性
- 一氧化碳的化学性质--还原性一氧化碳的化学性质--还原性
- 碳及其化合物的相互转化关系碳及其化合物的相互转化关系
- 燃料及其利用燃料及其利用
- 燃烧和燃烧的条件燃烧和燃烧的条件
- 探究燃烧的条件探究燃烧的条件
- 灭火的原理和方法灭火的原理和方法
- 灭火器灭火器
- 易燃物和易爆物的安全知识易燃物和易爆物的安全知识
- 化学反应中的能量变化化学反应中的能量变化
- 煤和石油煤和石油
- 天然气天然气
- 合理利用与开发化石能源合理利用与开发化石能源
- 使用燃料对环境的影响使用燃料对环境的影响
- 能源的利用与开发能源的利用与开发
- 金属和金属材料金属和金属材料
- 几种重要的金属几种重要的金属
- 合金合金
- 金属与氧气的反应金属与氧气的反应
- 探究金属与盐酸、稀硫酸的反应探究金属与盐酸、稀硫酸的反应
- 金属与盐酸、稀硫酸的反应金属与盐酸、稀硫酸的反应
- 金属与酸反应-图象问题(一)金属与酸反应-图象问题(一)
- 金属与酸反应-图象问题(二)金属与酸反应-图象问题(二)
- 金属与酸反应-天平问题金属与酸反应-天平问题
- 金属与酸反应-混合物计算金属与酸反应-混合物计算
- 置换反应置换反应
- 探究金属活动性顺序探究金属活动性顺序
- 金属活动性顺序及其应用金属活动性顺序及其应用
- 选择试剂验证金属的活动性顺序选择试剂验证金属的活动性顺序
- 金属质量变化的判断金属质量变化的判断
- 滤液与滤渣滤液与滤渣
- 金属流程金属流程
- 金属资源的利用和保护金属资源的利用和保护
- 金属在自然界中的存在金属在自然界中的存在
- 工业炼铁工业炼铁
- 一氧化碳还原氧化铁实验一氧化碳还原氧化铁实验
- 铁生锈条件的探究铁生锈条件的探究
- 金属资源保护金属资源保护
- 溶液溶液
- 溶液的形成、概念及特征溶液的形成、概念及特征
- 溶液的组成、命名及用途溶液的组成、命名及用途
- 溶解时的吸热或放热现象溶解时的吸热或放热现象
- 乳化现象乳化现象
- 饱和溶液和不饱和溶液饱和溶液和不饱和溶液
- 饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系
- 结晶结晶
- 固体溶解度固体溶解度
- 固体溶解度的表示方法固体溶解度的表示方法
- 固体溶解度曲线的应用固体溶解度曲线的应用
- 气体溶解度气体溶解度
- 溶质的质量分数溶质的质量分数
- 溶质质量分数和溶解度的区别和联系溶质质量分数和溶解度的区别和联系
- 溶液计算―直接计算溶液计算―直接计算
- 溶液计算―稀释、浓缩问题溶液计算―稀释、浓缩问题
- 溶液计算―与化学方程式的相关计算溶液计算―与化学方程式的相关计算
- 溶液的配制溶液的配制
- 酸和碱酸和碱
- 酸、碱与指示剂作用酸、碱与指示剂作用
- 几种常见的酸几种常见的酸
- 浓硫酸的腐蚀性浓硫酸的腐蚀性
- 浓硫酸的稀释浓硫酸的稀释
- 酸的化学性质酸的化学性质
- 酸与金属氧化物的应用酸与金属氧化物的应用
- 几种常见的碱--氢氧化钠几种常见的碱--氢氧化钠
- 几种常见的碱--氢氧化钙几种常见的碱--氢氧化钙
- 碱的化学性质碱的化学性质
- 酸、碱分别具有相似化学性质的原因酸、碱分别具有相似化学性质的原因
- 中和反应中和反应
- 中和反应在实际中的应用中和反应在实际中的应用
- 溶液酸碱度的表示法-pH溶液酸碱度的表示法-pH
- 中和反应的验证中和反应的验证
- 溶液pH变化问题溶液pH变化问题
- 盐、化肥盐、化肥
- 氯化钠氯化钠
- 粗盐中难溶性杂质的去除粗盐中难溶性杂质的去除
- 碳酸钙碳酸钙
- 碳酸钠碳酸钠
- 碳酸氢钠碳酸氢钠
- 碳酸根离子的检验碳酸根离子的检验
- 复分解反应复分解反应
- 常见化肥的种类和作用常见化肥的种类和作用
- 化肥的简易鉴别化肥的简易鉴别
- 氮肥的简单鉴别氮肥的简单鉴别
- 化学与生活化学与生活
- 蛋白质蛋白质
- 糖类糖类
- 油脂和维生素油脂和维生素
- 化学元素与人体健康化学元素与人体健康
- 有机化合物有机化合物
- 有机合成材料有机合成材料
《溶液计算―稀释、浓缩问题》溶液计算―稀释、浓缩问题
1单选题
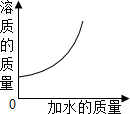
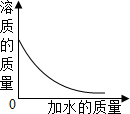
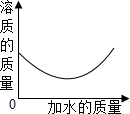
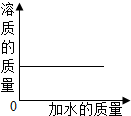
向一定质量分数的KNO$_3$溶液中逐渐加水稀释,下列图象中符合此溶液中溶质质量变化规律的是( )
题目答案
您的答案
答案解析
分析:
根据溶液稀释前后,溶质的质量不变,结合图象意进行分析解答.
解答:
解:溶液稀释前后,溶质的质量不变,则向一定质量分数的KNO$_3$溶液中逐渐加水稀释,溶质的质量不变.图象应该成一条水平直线,故D图象与实验操作过程对应一致.
故选D.
点评:
本题是一道图象坐标与溶液稀释相结合的题目,解题的关键是掌握稀释原理,注意分析坐标轴表示的意义、曲线的起点、折点及变化趋势,进而确定正确的图象.
2单选题
将200克溶质质量分数为10%的蔗糖溶液稀释到5%,需加水的质量为( )
题目答案
您的答案
答案解析
分析:
溶液在加水稀释的过程中溶质的质量不变,加入的水的质量就是稀浓溶液质量之差.
解答:
解:由于溶液在加水的过程中溶质的质量不变,因此需加水的质量为:$\frac {200g×10%}{5%}$-200g=200g,故选D.
点评:
本题难度不是很大,主要考查了有关溶质质量分数的简单计算,培养学生的分析问题和计算能力.
3单选题
在温度不变的条件下,下列欲使溶质的质量分数变为原来2倍的方法,最可行的是( )
题目答案
您的答案
答案解析
分析:
A、将20g硝酸钾饱和溶液蒸发掉10g水,蒸发水溶质硝酸钾析出,溶液仍为饱和溶液;一定温度下饱和溶液的溶质质量分数=$\frac {溶解度}{100+溶解度}$×100%;
B、将20g硝酸钾不饱和溶液蒸发掉10g水,在不析出晶体时,蒸发水后溶液质量减小而溶质质量不变,由溶质质量分数公式判断蒸发后溶液的质量分数;
C、在10g10%的硝酸钾溶液中,加入5g40%的硝酸钾溶液,混合后溶液的质量为两溶液质量和、溶质质量为两溶液中溶质质量和,由溶质质量分数公式计算混合后溶液的质量分数;
D、将10g硝酸钾不饱和溶液中加入10g硝酸钾固体,能否全部溶解无法判断且原溶液的溶质质量分数不明确,无法确切得知所得溶液的溶质质量分数.
解答:
解:A、在温度不变的条件下,将20g硝酸钾饱和溶液蒸发掉10g水,蒸发水溶质硝酸钾析出,溶液仍为饱和溶液;温度不变,硝酸钾的溶解度不变,饱和溶液的溶质质量分数不变;故A不可行;
B、将20g硝酸钾不饱和溶液蒸发掉10g水,在不析出晶体时,蒸发水后因溶液的质量减少一半而溶质质量不变,溶质质量分数增大一倍为原溶液的2倍;但若蒸发过程中有硝酸钾析出,则所得溶液质量分数将不能变为原溶液的2倍;故B不可行;
C、在10g10%的硝酸钾溶液中,加入5g40%的硝酸钾溶液,混合后溶液的溶质质量分数=$\frac {10g×10%+5g×40%}{10g+5g}$×100%=20%,为原溶液10%的2倍;故C正确;
D、因所加硝酸钾是否全部溶解不能确定而且原溶液的溶质质量分数也未明确,因此无法准确判断所得溶液的溶质质量分数;故D不可行;
故选C.
点评:
对不饱和溶液蒸发掉原溶液质量的一半水时,若不析出固体,则溶液的溶质质量分数增大一倍.
4填空题
实验室一瓶浓硫酸的商标如图所示,根据有关信息计算.
(1)启封前该瓶浓硫酸溶液的质量是g.
(2)取该浓硫酸10g,可配制成19.6%的稀硫酸g.
题目答案
您的答案
答案解析
分析:
(1)由标签可读取该瓶浓硫酸的体积500mL、密度1.84g/cm_,利用m=ρV可计算该瓶浓硫酸的质量;
(2)用98%的浓硫酸配制19.6%的稀硫酸需要加水进行稀释,根据稀释前后溶液中硫酸质量不变,由稀释前浓硫酸的质量计算可配制的稀硫酸的质量.
解答:
解:(1)由标签可知该瓶浓硫酸的体积500mL、密度1.84g/cm_,启封前该瓶浓硫酸溶液的质量=500mL×1.84g/cm_=920g
(2)可配制成19.6%的稀硫酸的质量=$\frac {10g×98%}{19.6%}$=50g
故答案为:(1)920;(2)50.
点评:
根据溶液中溶质质量=$\frac {溶质质量}{溶液质量}$×100%,利用其中任意两个已知量可计算出与溶液相关的第三个量.
5单选题
现将100克20%的稀硫酸稀释为10%的稀硫酸,所得稀硫酸溶液的质量为( )
题目答案
您的答案
答案解析
分析:
本题可根据溶液在稀释前后溶质的质量不变,利用列等式的方法来计算得到所得稀硫酸溶液的质量.
解答:
根据溶液在稀释前后溶质的质量不变,设所得稀硫酸溶液的质量为xg,则
100g×20%═xg×10%
解得x═200g
故选C.
点评:
本题考查溶液的稀释计算,关键是利用好在稀释过程中溶质的质量不发生变化来解答.
6单选题
将2%硫酸和5%硫酸按2:1的体积比混合后(设两种溶液密度均等于1g/mL),所得溶液中溶质的质量分数为( )
题目答案
您的答案
答案解析
分析:
溶液混合时,混合后溶液的质量等于混合前两溶液的质量和,混合后溶液中溶质的质量等于混合前两溶液中溶质的质量和;因此为计算等体积的浓、稀硫酸混合后所得溶液的溶质质量分数,需要对混合前两种硫酸溶液的体积、利用假设的数据对混合后溶液的溶质质量分数借助数学手段进行讨论,最终做出判断.
解答:
解:设5%的硫酸的体积是1ml则2%的硫酸体积是2ml.
所得溶液的溶质质量分数=$\frac {1ml×1g/ml×5%+2ml×1g/ml×2%}{3ml×1g/ml}$×100%=3%
故选A
点评:
此题是对溶质质量分数的考查题,解题的关键是能利用液体体积以及密度求出溶液的质量,再利用溶质的质量分数的计算解决问题.
7单选题
有甲、乙两种硫酸溶液,甲溶液中溶质的质量分数为20%,乙溶液中溶质的质量分数为10%.取甲、乙两种溶液等体积混合,则混合后溶液中溶质的质量分数为( )
题目答案
您的答案
答案解析
分析:
根据溶质质量分数的计算公式来求解,混合后溶质质量为混合前两溶液中溶质质量之和,混合后溶液质量为混合前溶液质量之和.
解答:
解:溶质的质量分数分别为20%和10%的两种硫酸溶液等质量混合后,溶液中的溶质的质量分数为$\frac {20%+10%}{2}$=15%,哪种溶液的质量大,就偏向于谁的溶质质量分数,由于20%硫酸溶液的密度大于10%硫酸溶液的密度,所以20%和10%的两种硫酸溶液等体积混合后,20%硫酸溶液的质量大于10%硫酸溶液的质量,所以混合后溶液中的溶质的质量分数大于15%.
故选A.
点评:
通过回答本题知道了两种溶质质量分数不同的两种溶液等体积混合后,溶液中的溶质的质量分数的判断方法:谁的质量大就偏向于谁.
8单选题
要使100克含水99%的食盐溶液变成含水98%的食盐溶液,可采用的措施有( )
题目答案
您的答案
答案解析
分析:
要使100克含水99%的食盐溶液变成含水98%的食盐溶液,即使溶液中溶质的质量分数由1%变为2%;根据溶质的质量分数计算方法计算即可.
解答:
解:要使100克含水99%的食盐溶液变成含水98%的食盐溶液,即使溶液中溶质的质量分数由1%变为2%,100克含水99%的食盐溶液中水的质量是100g×99%=49g,食盐的质量是100g-99g=1g;
A、再加入1g食盐,溶质质量分数是:$\frac {100g×1%+1g}{100g+1g}$×100%=1.98%,不满足要求,故A错误;
B、蒸发掉49g水,则溶质质量是1g,溶液质量是100g-49g=51g,所以溶质质量分数是:$\frac {1g}{51g}$×100%=1.96%,不满足要求,故B错误;
C、加1%的食盐溶液100,质量分数相同的溶液混合后,质量分数不变,故C错误;
D、蒸发掉50g水,则溶质质量是1g,溶液质量是100g-50g=50g,所以溶质质量分数是:$\frac {1g}{50g}$×100%=18.2%,满足要求,正确;
故选D.
点评:
在解此类题时,首先找出溶质质量和溶液质量,然后计算溶质质量分数与题中的要求进行比较分析,要使溶质的质量分数加倍,蒸发溶剂的质量=原溶液质量的一半,可作为规律直接使用.
9单选题
实验室用密度为1.84g/cm_、质量分数为98%的浓硫酸和蒸馏水,配制500g 质量分数为20%的稀硫酸.需要用多少mL的量筒量取多少mL的浓硫酸?( )
题目答案
您的答案
答案解析
分析:
用浓溶液来配制稀溶液,溶液中溶质的质量不变.
解答:
解:由于溶液稀释过程中溶质的质量不变,则需浓硫酸的体积为:$\frac {500g×20%}{98%×1.84g/mL}$=55.5mL,
由于需量取55.5mL,应选择量程与之接近的量筒,故选B.
点评:
本题难度较大,主要考查了有关溶液稀释的计算,从而培养学生的理解能力和计算能力.
10单选题
要配制质量分数为20%的硫酸溶液,需用质量分数分别为60%、10%的硫酸溶液的质量比为( )
题目答案
您的答案
答案解析
分析:
根据浓溶液与稀溶液混合前后溶质的质量不变,溶质质量=溶液质量×溶质的质量分数,结合题意进行分析解答.
解答:
解:浓溶液与稀溶液混合前后溶质的质量不变,设需用质量分数分别为60%、10%的硫酸溶液的质量分别为x、y,
则60%x:10%y=(x+y)×20% x:y=1:4.
故选:D.
点评:
本题难度不大,掌握浓溶液与稀溶液混合前后溶质的质量不变是正确解答本题的关键.
11单选题
2010年4月青海大地震后,医护人员用质量分数为5%的双氧水(H$_2$O$_2$)溶液为受伤病人清洗伤口,若一次配制5%的双氧水溶液600g,需要30%的高浓度双氧水的质量为( )
题目答案
您的答案
答案解析
分析:
根据稀释前后过氧化氢的质量前后保持不变,依据计算公式:M(浓)×W(浓)=M(稀)×W(稀)进行分析解答.
解答:
解:根据稀释前后双氧水的质量前后保持不变,设需要30%的高浓度双氧水的质量为x,依据计算公式可得:[br]600g×5%=30%x,[br]则 x=100g.[br]故选:B.
点评:
溶液稀释前后有关溶质的质量分数的计算.此时,由于溶液稀释前后,溶质的质量是不变的.
12单选题
现将100克10%的食盐溶液,若将其溶质质量分数增大一倍,可采用的方法是( )
题目答案
您的答案
答案解析
分析:
要使溶液的溶质质量分数变大,常通过两种方式:①加入溶质,②蒸发溶剂,据此结合溶质质量分数的计算进行分析判断.
解答:
解:100g10%的食盐溶液含溶质的质量为100g×10%=10g,含溶剂100g-10g=90g.
A、设需要蒸发水的质量为x,(100g-x)×20%=100g×10%,x=50g,应将溶剂蒸发掉溶液质量的一半,而不是溶剂质量的一半,故选项采用的方法错误.
B、根据A选项的分析,蒸发水的质量应为50g,故选项采用的方法错误.
C、设需要再溶解该物质的质量为y,(100g+y)×20%=100g×10%+y,y=12.5g,故选项采用的方法正确.
D、根据C选项的分析,加入氯化钠的质量应为12.5g,故选项采用的方法错误.
故选:C.
点评:
本题难度不是很大,考查溶液的浓缩问题,掌握溶液浓缩的方法、原理是正确解答此类题的关键所在.
13多选题
(多选)现有溶质质量分数为8%的食盐水40g,要使溶液中氯化钠的质量分数达到20%,以下说法正确的是( )
题目答案
您的答案
答案解析
分析:
根据溶质的质量分数=$\frac {溶质的质量}{溶液的质量}$×100%,要使溶质的质量分数变大,可采取增加溶质、蒸发溶剂、利用浓溶液配制的方法,并结合选项分析解答.
解答:
解:A、设加入溶质的质量为x,则有$\frac {8%×40g+x}{40g+x}$×100%=20%,解得x=6g,故错误;
B、设蒸发水的质量为y,则有$\frac {8%×40g}{40g-y}$×100%=20%,解得y=24g,故错误;
C、由B计算可知,需要蒸发水分24g,正确;
D、若加入质量分数为25%的食盐水96g,溶质的质量分数为$\frac {25%×96g +8%×40g}{40g+96g}$×100%=20%,正确;
故选CD.
点评:
本题难度不大,考查了对溶质质量分数的计算的了解和应用,掌握相关知识即可顺利解答.
14单选题
将200g 10%的氯化钠溶液变成20%的溶液,需要蒸发掉水的质量为( )
题目答案
您的答案
答案解析
分析:
本题应从溶液浓缩的角度进行思考,充分运用质量分数公式进行计算.
解答:
解:设需要蒸发掉水的质量为x.据溶液浓缩前后溶质的质量不变可得方程
(200g-x)×20%=200g×10%
解得:x=100g
故选D.
点评:
本题考察了溶液质量分数计算问题中的溶液浓缩问题,在解这类问题时,注意溶液浓缩前后溶质的质量不变.
15填空题
将100克含水98%的氯化钠溶液的含水量降到96%,应蒸发掉克水.
题目答案
您的答案
答案解析
分析:
根据溶液蒸发前后,溶质的质量不变,结合题意进行分析解答.
解答:
解:设要蒸发水的质量为x,根据溶液蒸发前后,溶质的质量不变,
则100g×(1﹣98%)=(100g﹣x)×(1﹣96%) x=50g.
故答案为:50.
点评:
本题难度不大,考查溶液的蒸发问题,掌握溶液蒸发前后溶质的质量不变是正确解答此类题的关键所在.
16填空题
工人师傅要用98%的浓硫酸(密度为1.84 g/cm_)稀释成15%的稀硫酸来清洗钢铁的铁锈(水的密度为1 g/cm_),求:
(l)500mL溶质质量分数为98%的浓硫酸的质量为g,其中溶质的质量为g.
(2)将500 mL 98%的浓硫酸稀释成15%的稀硫酸,约需用水mL.
题目答案
您的答案
答案解析
分析:
(1)根据m=ρV,可由浓硫酸的体积和密度计算浓硫酸溶液的质量;利用溶质质量=溶液质量×溶液的质量分数,计算溶液中溶质的质量;
(2)加水稀释时,溶液中溶质质量不变,利用此等量关系,可根据浓硫酸的质量计算出加水稀释时所需要水的量.
解答:
解:(1)500mL溶质质量分数为98%的浓硫酸的质量=500mL×1.84 g/cm_=920g;
其中溶质的质量=920g×98%=901.6g
故答案为:920;901.6;
(2)设需要用水的质量为x
500mL×1.84 g/cm_×98%=(500mL×1.84 g/cm_+x)×15%
x≈5090.7g(合5090.7mL)
故答案为:5090.7
点评:
由于数据较复杂,在进行类似的计算时,数据处理要耐心细致,避免因大意而计算误差造成结果的错误.
17填空题
有100g 10%的食盐溶液,要使其质量分数变为20%,有三种方法,按要求填空:[br](1)继续加入食盐,其质量为g;[br](2)蒸发水分,其质量为g;[br](3)与质量分数大于20%的浓食盐溶液混合,若混入25%的食盐溶液,其溶液质量为g。
题目答案
您的答案
答案解析
分析:
[br](1)根据稀溶液中溶质的质量与继续加入食盐的质量的和等于浓溶液中溶质的质量来列式解答;[br](2)根据溶液在蒸发前后溶质的质量不变来列等式解答;[br](3)根据两份溶液在混合时溶质的质量之和等于所得溶液中溶质的质量来解答。
解答:
[br]解:(1)设继续加入的食盐的质量为x,[br]则100g×10%+x=(100g+x)×20%[br]解得x=12.5g[br](2)设蒸发水的质量为y,[br]则根据蒸发前后溶质的质量不变得,[br]100g×10%=(100g﹣y)×20%[br]解得y=50g[br](3)设质量分数为25%的溶液为z,[br]则10%的溶液中的溶质与25%的溶液中的溶质之和等于20%溶液中的溶质,[br]100g×10%+z×25%=(100g+z)×20%[br]解得z=200g[br]故答案为:(1)12.5;(2)50;(3)200。
点评:
[br]本题考查了三种增大溶液质量分数的方法及其计算,学生需要明确不同方法中变化的量和不变的量,明确溶质的关系来解答。
18填空题
现有80g质量分数为10%的硝酸钠溶液,试回答下列问题:[br](1)上述硝酸钠溶液中含溶质的质量为g,溶剂的质量为g;[br](2)若向上述溶液中加入20g水,则溶液中溶质质量分数为%;[br](3)若向上述溶液中加入20g硝酸钠,全部溶解后溶液中溶质的质量分数为%;[br](4)若使上述溶液中溶质的质量分数变为5%,则应加水g。
题目答案
您的答案
答案解析
分析:
解答:
点评:
[br]本题难度不大,掌握溶质质量分数的有关计算、溶液稀释前后溶质的质量不变是正确解答本题的关键所在。