- 化学使世界变得更加绚丽多彩化学使世界变得更加绚丽多彩
- 什么是化学什么是化学
- 化学发展史化学发展史
- 走进化学世界走进化学世界
- 化学变化和物理变化化学变化和物理变化
- 化学性质和物理性质化学性质和物理性质
- 对蜡烛及其燃烧的探究对蜡烛及其燃烧的探究
- 对人体吸入的空气和呼出的气体的探究对人体吸入的空气和呼出的气体的探究
- 简单仪器简单仪器
- 药品的取用药品的取用
- 天平的使用天平的使用
- 量筒的使用量筒的使用
- 酒精灯的使用酒精灯的使用
- 连接仪器装置连接仪器装置
- 玻璃仪器洗干净的标准玻璃仪器洗干净的标准
- 我们周围的空气我们周围的空气
- 空气中氧气含量的测定实验空气中氧气含量的测定实验
- 空气成分空气成分
- 纯净物混合物的分类纯净物混合物的分类
- 空气中氮气和稀有气体的用途空气中氮气和稀有气体的用途
- 空气污染及防治空气污染及防治
- 氧气氧气
- 氧气的物理性质氧气的物理性质
- 木炭燃烧木炭燃烧
- 硫燃烧硫燃烧
- 铁燃烧铁燃烧
- 氧气的化学性质和用途氧气的化学性质和用途
- 氧化反应氧化反应
- 化合反应与氧化反应化合反应与氧化反应
- 加热高锰酸钾制氧气加热高锰酸钾制氧气
- 过氧化氢溶液制氧气过氧化氢溶液制氧气
- 氧气的收集、验满与检验氧气的收集、验满与检验
- 气体制取装置的选择气体制取装置的选择
- 催化剂催化剂
- 分解反应分解反应
- 氧气的工业制法氧气的工业制法
- 物质构成的奥秘物质构成的奥秘
- 物质的构成及分子的特征物质的构成及分子的特征
- 探究分子运动实验探究分子运动实验
- 分子分子
- 用分子的观点解释物质的组成用分子的观点解释物质的组成
- 用分子的观点解释物质的变化用分子的观点解释物质的变化
- 分子与原子的区别与联系分子与原子的区别与联系
- 原子的构成原子的构成
- 原子核外电子的排布原子核外电子的排布
- 原子结构示意图原子结构示意图
- 原子结构与原子化学性质的关系原子结构与原子化学性质的关系
- 离子的定义及分类离子的定义及分类
- 离子符号的写法与意义离子符号的写法与意义
- 相对原子质量相对原子质量
- 相对原子质量、质子数、中子数之间的关系相对原子质量、质子数、中子数之间的关系
- 元素的定义元素的定义
- 地壳中元素的含量地壳中元素的含量
- 元素符号的写法及意义元素符号的写法及意义
- 元素周期表简介及元素周期表提供的信息元素周期表简介及元素周期表提供的信息
- 自然界的水自然界的水
- 爱护水资源爱护水资源
- 自来水净化自来水净化
- 过滤过滤
- 硬水和软水硬水和软水
- 氢气的性质与检验氢气的性质与检验
- 水的组成实验水的组成实验
- 纯净物的分类――单质、化合物、氧化物纯净物的分类――单质、化合物、氧化物
- 化学式的意义化学式的意义
- 化学式的读写化学式的读写
- 化合价化合价
- 化合价的应用化合价的应用
- 原子团原子团
- 化学符号及周边数字的意义化学符号及周边数字的意义
- 有关相对分子质量的计算有关相对分子质量的计算
- 化学方程式化学方程式
- 化学反应前后物质的质量关系的实验探究化学反应前后物质的质量关系的实验探究
- 质量守恒定律质量守恒定律
- 实验探究质量守恒定律时应注意的问题实验探究质量守恒定律时应注意的问题
- 质量守恒定律的微观解释质量守恒定律的微观解释
- 质量守恒定律的相关计算质量守恒定律的相关计算
- 化学方程式化学方程式
- 化学方程式的书写原则与步骤化学方程式的书写原则与步骤
- 化学方程式的配平方法化学方程式的配平方法
- 化学方程式的简单计算化学方程式的简单计算
- 碳和碳的氧化物碳和碳的氧化物
- 碳的几种单质碳的几种单质
- 常温下化学性质稳定常温下化学性质稳定
- 碳与氧气的反应——可燃性碳与氧气的反应——可燃性
- 碳与某些氧化物的反应——还原性碳与某些氧化物的反应——还原性
- 二氧化碳的实验室制法二氧化碳的实验室制法
- 二氧化碳的实验室制法原料的选择二氧化碳的实验室制法原料的选择
- 二氧化碳的物理性质二氧化碳的物理性质
- 二氧化碳的化学性质--与水的反应二氧化碳的化学性质--与水的反应
- 二氧化碳的化学性质--与澄清石灰水的反应二氧化碳的化学性质--与澄清石灰水的反应
- 二氧化碳的用途及危害二氧化碳的用途及危害
- 一氧化碳的物理性质和毒性一氧化碳的物理性质和毒性
- 一氧化碳的化学性质--可燃性一氧化碳的化学性质--可燃性
- 一氧化碳的化学性质--还原性一氧化碳的化学性质--还原性
- 碳及其化合物的相互转化关系碳及其化合物的相互转化关系
- 燃料及其利用燃料及其利用
- 燃烧和燃烧的条件燃烧和燃烧的条件
- 探究燃烧的条件探究燃烧的条件
- 灭火的原理和方法灭火的原理和方法
- 灭火器灭火器
- 易燃物和易爆物的安全知识易燃物和易爆物的安全知识
- 化学反应中的能量变化化学反应中的能量变化
- 煤和石油煤和石油
- 天然气天然气
- 合理利用与开发化石能源合理利用与开发化石能源
- 使用燃料对环境的影响使用燃料对环境的影响
- 能源的利用与开发能源的利用与开发
- 金属和金属材料金属和金属材料
- 几种重要的金属几种重要的金属
- 合金合金
- 金属与氧气的反应金属与氧气的反应
- 探究金属与盐酸、稀硫酸的反应探究金属与盐酸、稀硫酸的反应
- 金属与盐酸、稀硫酸的反应金属与盐酸、稀硫酸的反应
- 金属与酸反应-图象问题(一)金属与酸反应-图象问题(一)
- 金属与酸反应-图象问题(二)金属与酸反应-图象问题(二)
- 金属与酸反应-天平问题金属与酸反应-天平问题
- 金属与酸反应-混合物计算金属与酸反应-混合物计算
- 置换反应置换反应
- 探究金属活动性顺序探究金属活动性顺序
- 金属活动性顺序及其应用金属活动性顺序及其应用
- 选择试剂验证金属的活动性顺序选择试剂验证金属的活动性顺序
- 金属质量变化的判断金属质量变化的判断
- 滤液与滤渣滤液与滤渣
- 金属流程金属流程
- 金属资源的利用和保护金属资源的利用和保护
- 金属在自然界中的存在金属在自然界中的存在
- 工业炼铁工业炼铁
- 一氧化碳还原氧化铁实验一氧化碳还原氧化铁实验
- 铁生锈条件的探究铁生锈条件的探究
- 金属资源保护金属资源保护
- 溶液溶液
- 溶液的形成、概念及特征溶液的形成、概念及特征
- 溶液的组成、命名及用途溶液的组成、命名及用途
- 溶解时的吸热或放热现象溶解时的吸热或放热现象
- 乳化现象乳化现象
- 饱和溶液和不饱和溶液饱和溶液和不饱和溶液
- 饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系
- 结晶结晶
- 固体溶解度固体溶解度
- 固体溶解度的表示方法固体溶解度的表示方法
- 固体溶解度曲线的应用固体溶解度曲线的应用
- 气体溶解度气体溶解度
- 溶质的质量分数溶质的质量分数
- 溶质质量分数和溶解度的区别和联系溶质质量分数和溶解度的区别和联系
- 溶液计算―直接计算溶液计算―直接计算
- 溶液计算―稀释、浓缩问题溶液计算―稀释、浓缩问题
- 溶液计算―与化学方程式的相关计算溶液计算―与化学方程式的相关计算
- 溶液的配制溶液的配制
- 酸和碱酸和碱
- 酸、碱与指示剂作用酸、碱与指示剂作用
- 几种常见的酸几种常见的酸
- 浓硫酸的腐蚀性浓硫酸的腐蚀性
- 浓硫酸的稀释浓硫酸的稀释
- 酸的化学性质酸的化学性质
- 酸与金属氧化物的应用酸与金属氧化物的应用
- 几种常见的碱--氢氧化钠几种常见的碱--氢氧化钠
- 几种常见的碱--氢氧化钙几种常见的碱--氢氧化钙
- 碱的化学性质碱的化学性质
- 酸、碱分别具有相似化学性质的原因酸、碱分别具有相似化学性质的原因
- 中和反应中和反应
- 中和反应在实际中的应用中和反应在实际中的应用
- 溶液酸碱度的表示法-pH溶液酸碱度的表示法-pH
- 中和反应的验证中和反应的验证
- 溶液pH变化问题溶液pH变化问题
- 盐、化肥盐、化肥
- 氯化钠氯化钠
- 粗盐中难溶性杂质的去除粗盐中难溶性杂质的去除
- 碳酸钙碳酸钙
- 碳酸钠碳酸钠
- 碳酸氢钠碳酸氢钠
- 碳酸根离子的检验碳酸根离子的检验
- 复分解反应复分解反应
- 常见化肥的种类和作用常见化肥的种类和作用
- 化肥的简易鉴别化肥的简易鉴别
- 氮肥的简单鉴别氮肥的简单鉴别
- 化学与生活化学与生活
- 蛋白质蛋白质
- 糖类糖类
- 油脂和维生素油脂和维生素
- 化学元素与人体健康化学元素与人体健康
- 有机化合物有机化合物
- 有机合成材料有机合成材料
《溶质质量分数和溶解度的区别和联系》溶质质量分数和溶解度的区别和联系
1单选题
下列说法中,正确的是( )
题目答案
您的答案
答案解析
分析:
A.根据溶液的均一性来分析;B.根据溶液中溶质的质量分数计算的方法来分析;C.根据溶液中溶质的质量分数计算的方法来分析;D.根据溶液中溶质的质量分数计算的方法来分析.
解答:
解:A.溶液具有均一性,从溶质质量分数为20%的100g氯化钠溶液中取出10g溶液,则取出的溶液中溶质的质量分数仍为20%,故错误;B.100g氯化钠溶液中含有15g氯化钠,再往其中加入1g氯化钠,并使其完全溶解,则溶液中溶质的质量分数为:$\frac {15g+1g}{100g+1g}$×100%<16%,故错误;C.400g甘油溶解在100g水中,所得甘油溶液中,溶质的质量分数为:$\frac {400g}{400g+100g}$×100%=80%,故正确;D.在100g水中溶解20g氯化钠,所得溶液中,溶质的质量分数为:$\frac {20g}{20g+100g}$×100%<20%,故错误.故选C.
点评:
把握住溶液中溶质的质量分数=$\frac {溶质的质量}{溶液的质量}$×100%进行分析计算.
2单选题
60℃时,A、B两种物质的溶解度A<B.分别取等质量的A、B两种物质的饱和溶液,降温至30℃,析出A、B晶体的质量分别为m g和n g(A、B均不含结晶水).下列判断正确的是( )
题目答案
您的答案
答案解析
分析:
A、根据60℃时,物质A与物质B饱和溶液的质量不知道进行解答;
B、根据30℃时A、B的溶解度大小不知道进行解答;
C、根据30℃时,若A的溶解度比B大,而60℃时,物质A的溶解度比B小,说明B物质的溶解度受温度影响较大进行解答;
D、根据30℃时,若A的溶解度比B小,而60℃时,物质A的溶解度也比B小,不能说明A、B物质的溶解度哪一个受温度影响较大进行解答.
解答:
A、虽然60℃时,物质A的溶解度比B小,但是60℃时,A饱和溶液与B饱和溶液的质量不知道,所以无法比较二者者所含溶质的质量的大小,故A错误;
B、根据30℃时A、B的溶解度大小不知道,所以无法比较30℃时A饱和溶液与B饱和溶液的溶质质量分数大小,故B错误;
C、30℃时,若溶解度A>B,而60℃时,溶解度A<B,说明B物质的溶解度受温度影响较大,所以等质量的A、B两物质的饱和溶液,降温至30℃,m一定小于n,故C正确;
D、30℃时,若A的溶解度比B小,而60℃时,物质A的溶解度也比B小,不能说明A、B物质的溶解度哪一个受温度影响较大,所以无法比较m、n的大小,故D错误.
故选:C.
点评:
主要考查了固体溶解度的概念,提高学生的理解能力和培养学生的分析问题、解决问题的能力.
3单选题
如图是a、b两种固体物质的溶解度曲线.从图中获得的信息错误的是( )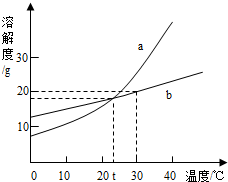
题目答案
您的答案
答案解析
分析:
A、根据a物质的溶解度随温度升高而增大分析.
B、从溶解度曲线图可以看出该温度b物质的溶解度为20g分析.
C、根据在t℃时a、b的溶解度相等,饱和溶液溶质质量分数=$\frac {溶解度}{100g+溶解度}$×100%分析.
D、根据30℃时,b物质饱和溶液的溶质质量分数=$\frac {20g}{20g+100g}$×100%分析.
解答:
解:A、a物质的溶解度随温度升高而增大,A说法正确.
B、从溶解度曲线图可以看出该温度b物质的溶解度为20g,B说法正确.
C、在t℃时a、b的溶解度相等和饱和溶液溶质质量分数=$\frac {溶解度}{100g+溶解度}$×100%,溶解度相等所以饱和溶液溶质质量分数相等,C说法正确.
D、30℃时,b物质饱和溶液的溶质质量分数=$\frac {20g}{20g+100g}$×100%=16.7%,D说法不正确.
故选D.
点评:
溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度;同一温度下,不同溶质的溶解度;温度对不同物质的溶解度影响不同.
4单选题
下列变化中,溶液中原溶质的溶解度和溶质分量分数都发生变化的是( )
题目答案
您的答案
答案解析
分析:
A、硝酸钾的溶解度随温度升高而增大,升温溶解度会变大,但溶液溶质的质量分数不变.
B、生石灰溶于水会放热,使溶液的温度升高,溶解度会变化,但氧化钙溶于水会生成氢氧化钙,氢氧化钙会与氯化铁反应使溶质的量减小.
C、硫酸锌不与铜粉发生反应,不会使溶液有任何变化.
D、稀释能改变溶质的质量分数,但溶解度不变化.
解答:
A、硝酸钾的溶解度随温度升高而增大,升温溶解度会变大,但溶液本身并无改变,因此溶质的质量分数不变,故此选项错误.
B、生石灰溶于水会放热,使溶液的温度升高,使氯化铁的溶解度会变化,但氧化钙溶于水会生成氢氧化钙,氢氧化钙会与氯化铁反应使溶质的量减小会生成氢氧化铁的沉淀,当然溶质氯化铁会减小,故此选项正确.
C、硫酸锌不与铜粉发生反应,溶液没有任何变化,故此选项错误.
D、稀释能改变溶质的质量分数,但温度未发生变化,所以溶解度不变化,故此选项错误.
故选B
点评:
此题是对溶液相关知识的考查,解题的关键是了解溶液温度是否发生了改变,溶质的质量是否有所变化,属基础知识知识的考查.
5单选题
固体A、B的溶解度曲线如右图所示.
(1)10℃时,10g水中分别溶解A、B达饱和,溶解得更多的物质是{_ _}.
(2)当A、B的饱和溶液的溶质质量分数相同时,溶液的温度是{_ _}.
(3)把100g质量分数10%的B溶液从30℃降温到10℃,此B溶液的质量分数是{_ _}.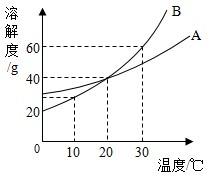
题目答案
您的答案
答案解析
分析:
根据物质的溶解度曲线,分析判断:10℃时,两种物质的溶解度大小;A、B的饱和溶液的溶质质量分数相同时的温度;计算B物质在降温时的溶液中溶质的质量分数;
解答:
解:(1)10℃时,A的溶解度大于B的溶解度,故10g水中分别溶解A、B达饱和,溶解得更多的物质是 A.
(2)20℃时,A、B的溶解度相等,故A、B的饱和溶液的溶质质量分数相同时,溶液的温度是20℃.
(3)100g质量分数10%的B溶液中溶质的质量为10g,而10℃B的溶解度大于10g,故从30℃降温到10℃,溶液的质量分数是 $\frac {10g}{100g}$×100%=10%
故答案为:(1)A;(2)20℃;(3)10%
点评:
本题难度不大,主要考查了固体溶解度曲线所表示的意义,通过本题可以加强学生对固体溶解度的理解,培养学生应用知识解决问题的能力.
6单选题
两种不含结晶水的固体物质a、b的溶解度曲线如图,下列说法正确的是( )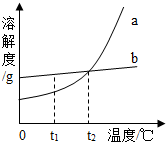
题目答案
您的答案
答案解析
分析:
根据物质的溶解度曲线,可以判断:根据b的溶解度随温度变化而变化的情况判断降温是否有结晶析出以及溶液结晶析出的方法;比较等质量的两种物质的饱和溶液所需水的质量.
解答:
解:A、由于固体物质的溶解度会随温度的变化而变化,从图中可以看出,只有在高于t$_2$℃时,b的溶解度小于a的溶解度,故A错误;
B、由于不知a、b两种物质的溶液是否饱和,故降温不一定由晶体析出,故B错误.
C、b的溶解度受温度的影响不大,要从含有少量a的b溶液中得到较多的b晶体,通常可采用蒸发结晶的方法,故C错误.
D、t$_2$℃时,a、b两种物质的溶解度相等,故在t$_2$℃时,用a、b两种固体和水分别配制等质量的两种物质的饱和溶液,需要量取相同体积的水,故D正确.
故选D.
点评:
主要考查了对固体溶解度的概念的理解和固体溶解度曲线的意义,以此培养学生的理解能力、培养学生分析问题、解决问题的能力.
7单选题
有一杯饱和的食盐水,小刚同学对它进行下列操作,溶质质量分数发生变化的是( )
题目答案
您的答案
答案解析
分析:
根据溶液具有均一性,饱和溶液中溶质的质量分数=$\frac {溶解度}{100g+溶解度}$×100%,氯化钠的溶解度受温度影响不大及溶质的质量分数计算方法分析解答.
解答:
A、再加水,溶质的质量不变,溶液的质量增加,所以溶质的质量分数减小,符合题意;
B、由于溶液具有均一性,所以倒出一部分溶液的溶质质量分数不变,故错误;
C、氯化钠的溶解度受温度影响不大,所以升高温度溶质、溶剂的质量不变,其溶质的质量分数不变,故错误;
D、恒温下,再加食盐,由于溶液已经是饱和溶液,加入溶质不再溶解,所以溶质的质量分数不变,故错误;
故选:A.
点评:
溶质的质量分数=$\frac {溶质的质量}{溶液的质量}$×100%,掌握食盐水的溶质氯化钠的性质、饱和溶液的概念等知识,才能正确分析解答.
8单选题
下列做法能改变溶液中溶质质量分数的是( )
题目答案
您的答案
答案解析
分析:
A、根据一定温度下饱和溶液的溶质质量分数不变分析,对氯化钠的饱和溶液进行恒温蒸发时,溶液的溶质质量分数的不变;B、根据硝酸钾的溶解度随温度升高而增大的特点,分析将硝酸钾的饱和溶液温度升高时,溶液组成的变化;C、根据氯化铵的溶解度随温度升高而增大的特点,分析对氯化铵饱和溶液降温时,溶质会析出;D、向蔗糖的饱和溶液中加入少量蔗糖后,蔗糖不再溶解.
解答:
A、把氯化钠的饱和溶液恒温蒸发水分,随水分蒸发溶质氯化钠析出,溶液仍为该温度下的饱和溶液;同一温度下的同种溶质的饱和溶液因溶解度相同,其饱和溶液的溶质质量分数也相同;故A不正确;B、将硝酸钾的饱和溶液温度升高,由于硝酸钾的溶解度随温度升高而增大,升温后的溶液变成了硝酸钾的不饱和溶液,其溶质、溶剂的量都不变,因此,所得溶液的溶质质量分数也不改变;故B不正确;C、将氯化铵的饱和溶液温度降低,由于氯化铵的溶解度随温度升高而增大,降温后将有氯化铵固体析出,由于溶质的析出降温后的溶液的溶质质量分数将减小;故C正确;D、向蔗糖的饱和溶液中加入少量的蔗糖,饱和溶液不能继续溶解所加入的蔗糖,因此,溶液中溶质、溶剂的质量都没有改变,溶液的溶质质量分数也不发生改变;故D不正确.故选:C.
点评:
溶液的溶质质量分数是指某溶液中溶质质量占溶液质量的百分比,因此,溶液的溶质、溶剂质量的改变会对溶液的溶质质量分数产生影响.分析溶质、溶剂的改变情况是解决类似问题的基本方法.
9单选题
根据如图判断,下列说法中错误的是( )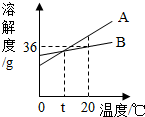
题目答案
您的答案
答案解析
分析:
A、据该温度下B的溶解度分析解答;
B、据溶解度曲线可知物质的溶解度随温度变化情况;
C、一定温度下饱和溶液中溶解度相等,则溶质的质量分数相等;
D、A的溶解度随温度的降低而减小,据此分析解答.
解答:
解:A、20℃时B的溶解度是36g,所以将20gB加入到50g水中,不能全部溶解,最多溶解18g,故错误;
B、由图可知:A、B的溶解度均随温度的升高而增大,正确;
C、饱和时溶质的质量分数=$\frac {溶解度}{溶解度+100g}$×100%,而t℃时二者的溶解度相等,所以A的饱和溶液和B的饱和溶液溶质质量分数相等,正确;
D、A的溶解度随温度的降低而减小,所以将将20℃时A的饱和溶液降温到0℃,会析出晶体,溶质的质量减小,溶剂的质量不变,所以溶质的质量分数减小,正确;
故选:A.
点评:
了解溶解度概念、溶解度曲线的意义,饱和溶液中溶质的质量分数的计算方法即可顺利解答.
10单选题
已知t℃时,氯化钾的溶解度为40g。在该温度下,将25g氯化钾固体加入到50g水中,充分溶解,形成的溶液中溶质的质量分数为( )
题目答案
您的答案
答案解析
分析:
解答:
点评:
熟记和理解溶质的质量分数、溶解性和溶解度的关系,根据溶解度来判断溶液是否达到了饱和状态,然后再进行相关计算。
11单选题
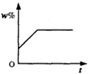
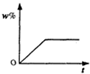
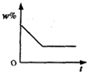
将100g食盐的不饱和溶液恒温蒸发水,直到有少量的晶体析出,在此过程中,关于溶质的质量分数(w%)与时间(t)的变化关系,下列图中描述正确的是( )
题目答案
您的答案
答案解析
分析:
恒温蒸发直至有晶体析出,在此变化过程中,溶液中溶质质量分数w%并不是从零开始的,随着时间的增加,其溶质质量分数会越来越大.直到有晶体析出,溶液达到饱和时,溶质质量分数达到最大且不再发生改变.
解答:
A、溶液中溶质质量分数w%,随着时间的增加,其溶质质量分数会越来越大,溶液达到饱和时,溶质质量分数达到最大且不再发生改变,而不是继续增大,故A错误;
B、溶液中溶质质量分数w%,随着时间的增加,其溶质质量分数会越来越大,溶液达到饱和时,溶质质量分数达到最大且不再发生改变,故B正确;
C、溶液中溶质质量分数w%并不是从零开始的,故C错误;
D、溶液中溶质质量分数w%,随着时间的增加,其溶质质量分数会越来越大,而不是减少,故D错误.
故选B.
点评:
本题将变化过程放入坐标系中进行探究,使得变化过程图象化,体现了变化的数形结合,能很好训练学生对相关知识的分析能力.
12单选题
在一定温度下,某物质的溶解度为25g.其饱和溶液溶质的质量分数为{_ _}%
题目答案
您的答案
答案解析
分析:
饱和溶液的溶质质量分数=$\frac {溶解度}{100g+溶解度}$×100%
解答:
解:溶解度是在一定温度下,某物质在100g溶剂里达到饱和状态时所溶解的溶质的质量.故饱和溶液的溶质质量分数=$\frac {溶解度}{100g+溶解度}$×100%=$\frac {25g}{100g+25g}$×100%=20%
故选A
点评:
理解溶解度定义,能根据溶解度定义得出饱和溶液溶质质量分数与溶解度之间的关系,并会进行计算.
13单选题
某温度下,向100g 水中加入30g CuSO$_4$粉末,充分溶解后,烧杯底部形成25g晶体(CuSO$_4$•5H$_2$O),则该温度下CuSO$_4$溶液中溶质质量分数为( )
题目答案
您的答案
答案解析
分析:
先计算晶体中硫酸铜的质量,然后再来计算溶解后溶液的质量,最后根据质量分数=$\frac {溶质的质量}{溶液的质量}$×100%求得所求.
解答:
解:晶体中CuSO$_4$的质量:
$\frac {CuSO$_4$}{MCuSO$_4$•5H$_2$O}$×100%×25g
=$\frac {160}{250}$×100%×25g
=16g,
则溶液中溶质质量为:30g-16g=14g
溶解后溶液总质量:100g+30g-25g=105g,
CuSO$_4$溶液中溶质质量分数:$\frac {14g}{105g}$×100%=13.3%;
故选A.
点评:
本题考查了溶质的质量分数.解答此题的难点是根据晶体CuSO$_4$•5H$_2$O的化学组成来求CuSO$_4$的质量.
14单选题
下列做法中,能够使20℃氢氧化钙饱和溶液的溶质质量分数改变的是( )
题目答案
您的答案
答案解析
分析:
根据氢氧化钙的溶解度随温度的升高而减小进行分析,改变溶质质量分数可以是改变水的质量或改变氢氧化钙的质量,据此解答.
解答:
解:A、升高温度到30℃,氢氧化钙的溶解度减小,会有氢氧化钙析出,溶质质量分数改变,正确;
B、温度不变,蒸发掉少量溶剂,则仍然是该温度下的饱和溶液,溶质质量分数不变,错误;
C、降低温度到10℃,氢氧化钙的溶解度增大,溶液的组成不变,溶质质量分数不变,错误;
D、温度不变,加入少量氢氧化钙固体,则不能继续溶解,溶质质量分数不变,错误;
故选A.
点评:
本题考查了饱和溶液和不饱和溶液的转化以及溶质质量分数的大小的判断,完成此题,可以依据已有的知识进行.
15单选题
20℃时氯化钠的溶解度为36g,则20℃时氯化钠的饱和溶液中溶质的质量分数为( )
题目答案
您的答案
答案解析
分析:
根据20℃时,氯化钠饱和溶液的溶质质量分数=$\frac {溶解度}{100g+溶解度}$×100%进行解答.
解答:
解:20℃时,氯化钠饱和溶液的溶质质量分数=$\frac {溶解度}{100g+溶解度}$×100%=$\frac {36g}{36g+100g}$×100%=26.5%.
故选:B.
点评:
该题主要考查饱和溶液中溶质质量分数的计算,解答时要找准该温度时的溶解度,用好计算公式:溶质质量分数=$\frac {溶解度}{100g+溶解度}$×100%.
16单选题
在一定温度下,某物质不饱和溶液的质量分数为a%,饱和溶液的质量分数为b%,溶解度为cg,则a、b、c之间的关系是( )
题目答案
您的答案
答案解析
分析:
根据在一定温度下,还能溶解某种溶质的溶液叫该物质的不饱和溶液,不能继续溶解某物质的溶液,叫该物质的饱和溶液进行解答.
解答:
解:在一定温度下,还能溶解某种溶质的溶液叫该物质的不饱和溶液,不能继续溶解某物质的溶液,叫该物质的饱和溶液,饱和溶液中氯化钠的量达到了最大溶解量,不饱和溶液中,溶质的溶解没有达到最大溶解量,所以b大于a;其中溶解度是指在一定温度下,在100g溶剂中达到饱和状态时溶解溶质的质量,溶解度为cg,则饱和溶液的质量分数=$\frac {cg}{100g+cg}$×100%<c%,所以a、b、c之间的关系是c>b>a.
故选C.
点评:
通过本题的解答,要对饱和溶液和不饱和溶液有一个全面的认识,同时注意温度限制,在平时的解题过程中,要加以理解.
17单选题
按下列方法配制的溶液,其溶质质量分数为5%的是( )
题目答案
您的答案
答案解析
分析:
本题应从溶质质量分数的计算和物质的溶解性等多方面考虑.A、氯化钾溶解于水根据数据计算可确定;B、熟石灰微溶于水;C、5.0mL浓盐酸是溶液的体积;D、碳酸钙不溶于水;
解答:
解:A、氯化钾能溶解于水,5.0g氯化钾,溶解在95mL.水中计算溶质质量分数为5g÷(5g+95g)=5%,故A正确;B、熟石灰微溶于水,故B错误;C、5.0mL浓盐酸是溶液的体积不能得出溶质氯化氢的质量,故不能求得溶质质量分数,故C错误;D、碳酸钙不溶于水,得不到溶液,故D错误;故选:A.
点评:
充分考虑溶质质量分数的计算和物质的溶解性,才能准确把握此题,得出一个正确的结果.
18单选题
将20℃时某KNO$_3$溶液均分为两份,第一份恒温蒸发掉10克水,析出a克晶体;第二份恒温蒸发掉20克水,析出晶体b克.则a与b的关系正确的是( )
题目答案
您的答案
答案解析
分析:
根据饱和溶液蒸发水会析出晶体,不饱和溶液蒸发水不会析出晶体,根据蒸发水的质量关系进行分析.
解答:
解:如果开始的硝酸钾溶液是饱和溶液,则蒸发掉20克水,是蒸发掉10g水的2倍,所以析出晶体的质量也是蒸发掉10g水析出晶体质量的2倍,即b=2a;如果开始的硝酸钾溶液是不饱和溶液,则一开始蒸发的10g水析出晶体的质量要比析出晶体后,最后饱和溶液蒸发10g水析出晶体的质量小,即2a<b,所以a与b的关系是2a≤b.
故选B.
点评:
解答本题关键是要知道饱和溶液蒸发水会析出晶体,不饱和溶液蒸发水不会析出晶体,什么时候成了饱和溶液了,再蒸发水才开始析出晶体.
19单选题
20℃时,恒温蒸发某硝酸钾溶液,第一次蒸发掉10克水,没有晶体析出;第二次又蒸发掉10克水,析出3克晶体;第三次再蒸发掉10克水,析出m克晶体( )
题目答案
您的答案
答案解析
分析:
根据溶液的状态进行分析,温度为T℃的硝酸钾溶液,两次恒温蒸发10g水,析出的晶体质量有可能相同也有可能不同,数值的大小关键是看原溶液是否饱和进行分析解答.
解答:
解:当原溶液是T℃的饱和溶液时,两次恒温蒸发掉10克水时析出的晶体应该相等,都等于3克,当原溶液是T℃的不饱和溶液时,则第二次蒸发掉10克水析出的晶体质量应该大于第一次析出的晶体质量,所以第二次蒸发10克水恢复到T℃析出晶体的质量为等于或者大于3克.
故选:D.
点评:
本题考查了根据溶解度的有关计算,完成此题,可以依据溶解度的概念进行.
20单选题
60℃时,A、B两种物质的溶解度A<B.分别取60℃时等质量的A、B两种物质的饱和溶液,降温至30℃,析出A、B晶体的质量分别为m g和n g(A、B均不含结晶水).下列判断正确的是( )
题目答案
您的答案
答案解析
分析:
根据已有的溶解度的知识以及溶液结晶的方法进行分析解答即可.
解答:
解:60℃时,A、B两种物质的溶解度A<B.分别取60℃时等质量的A、B两种物质的饱和溶液,降温至30℃,析出A、B晶体的质量分别为mg和ng,
A、30℃时,A、B两种物质的溶解度不一定为A<B,错误;
B、30℃时,A、B的溶解度大小不知道,饱和溶液中溶质的质量分数不一定为A=B,错误;
C、60℃时,A、B两种物质的溶解度A<B,30℃时,若溶解度A>B,则说明B的溶解度受温度影响变化大,则晶体质量一定为m<n,正确;
D、根据C分析可以知道,晶体质量一定为m<n,错误;
故选C.
点评:
本题考查的是溶解度的知识以及饱和溶液结晶的知识,完成此题,可以依据已有的知识进行.
21单选题
恒温时,m克某物质溶液蒸发掉0.6m克水,能析出0.1m克不含结晶水的该物质的晶体,再蒸发0.1m克的水,又能析出0.1m克晶体,则原溶液中溶质的质量分数为( )
题目答案
您的答案
答案解析
分析:
根据第二次蒸发属于饱和溶液蒸发,根据饱和溶液蒸发水析出晶体的质量计算出该物质的溶解度,再利用饱和溶液计算出含有的溶质质量,再加上开始不饱和溶液蒸发水析出晶体的质量,除以总溶液质量算出原溶液中溶质的质量分数.
解答:
解:由m克某物质溶液蒸发掉0.6m克水,能析出0.1m克不含结晶水的该物质的晶体,再蒸发0.1m克的水,又能析出0.1m克晶体,可知第二次蒸发属于饱和溶液蒸发,由蒸发0.1m克的水,又能析出0.1m克晶体可知饱和溶液中溶质和溶剂的质量比是1:1;在第一次蒸发水后所得溶液是饱和溶液,此时溶液质量为m-0.6m-0.1m=0.3m,所以这些溶液中含溶质质量为0.15m,所以原溶液中含溶质质量为:0.15m克+0.1m克=0.25m克,所以原溶液中溶质的质量分数为$\frac {0.25m克}{m克}$×100%=25%.
故选A.
点评:
解答本题关键是根据蒸发0.1m克的水,又能析出0.1m克晶体可知饱和溶液中溶质和溶剂的质量比是1:1,求出饱和溶液中含有溶质质量,再进行计算即可.
22单选题
某温度下,向盐A的饱和溶液(溶质质量分数为a%)中加入m g无水盐A,同温下析出ng A•xH$_2$O晶体,则从饱和溶液中析出的溶质质量为(设A的式量为M)( )
题目答案
您的答案
答案解析
分析:
根据溶液析出水合物后仍是饱和溶液,n克水合物中,分为两部分,一部分是加入的m克的无水盐;另一部分是饱和溶液的一部分,从原溶液中析出的溶质就在这部分里,而饱和溶液的溶质质量分数已知,则饱和溶液减少的质量为(n-m)g.然后利用饱和溶液中,溶质的质量=溶液的质量×饱和溶液的质量分数进行计算.
解答:
解:由题意可知,原溶液为饱和溶液,
则加入mg该无水盐后晶体析出后的溶液仍然为饱和溶液,
则饱和溶液减少的质量为(n-m)g也是饱和溶液,
由一定温度下,某无水盐在水中溶质的质量分数为a%,
从原饱和溶液中析出溶质的质量为x,
则 $\frac {X}{n-m}$×100%=a%
X=(n-m)×a%
故选项为:D.
点评:
本题考查学生饱和溶液中溶质质量的计算方法,依据饱和溶液中溶质的质量分数=$\frac {溶质的质量}{溶液的质量}$×100%计算即可,关键是分析饱和溶液中的溶质和溶液的质量.