- 化学使世界变得更加绚丽多彩化学使世界变得更加绚丽多彩
- 什么是化学什么是化学
- 化学发展史化学发展史
- 走进化学世界走进化学世界
- 化学变化和物理变化化学变化和物理变化
- 化学性质和物理性质化学性质和物理性质
- 对蜡烛及其燃烧的探究对蜡烛及其燃烧的探究
- 对人体吸入的空气和呼出的气体的探究对人体吸入的空气和呼出的气体的探究
- 简单仪器简单仪器
- 药品的取用药品的取用
- 天平的使用天平的使用
- 量筒的使用量筒的使用
- 酒精灯的使用酒精灯的使用
- 连接仪器装置连接仪器装置
- 玻璃仪器洗干净的标准玻璃仪器洗干净的标准
- 我们周围的空气我们周围的空气
- 空气中氧气含量的测定实验空气中氧气含量的测定实验
- 空气成分空气成分
- 纯净物混合物的分类纯净物混合物的分类
- 空气中氮气和稀有气体的用途空气中氮气和稀有气体的用途
- 空气污染及防治空气污染及防治
- 氧气氧气
- 氧气的物理性质氧气的物理性质
- 木炭燃烧木炭燃烧
- 硫燃烧硫燃烧
- 铁燃烧铁燃烧
- 氧气的化学性质和用途氧气的化学性质和用途
- 氧化反应氧化反应
- 化合反应与氧化反应化合反应与氧化反应
- 加热高锰酸钾制氧气加热高锰酸钾制氧气
- 过氧化氢溶液制氧气过氧化氢溶液制氧气
- 氧气的收集、验满与检验氧气的收集、验满与检验
- 气体制取装置的选择气体制取装置的选择
- 催化剂催化剂
- 分解反应分解反应
- 氧气的工业制法氧气的工业制法
- 物质构成的奥秘物质构成的奥秘
- 物质的构成及分子的特征物质的构成及分子的特征
- 探究分子运动实验探究分子运动实验
- 分子分子
- 用分子的观点解释物质的组成用分子的观点解释物质的组成
- 用分子的观点解释物质的变化用分子的观点解释物质的变化
- 分子与原子的区别与联系分子与原子的区别与联系
- 原子的构成原子的构成
- 原子核外电子的排布原子核外电子的排布
- 原子结构示意图原子结构示意图
- 原子结构与原子化学性质的关系原子结构与原子化学性质的关系
- 离子的定义及分类离子的定义及分类
- 离子符号的写法与意义离子符号的写法与意义
- 相对原子质量相对原子质量
- 相对原子质量、质子数、中子数之间的关系相对原子质量、质子数、中子数之间的关系
- 元素的定义元素的定义
- 地壳中元素的含量地壳中元素的含量
- 元素符号的写法及意义元素符号的写法及意义
- 元素周期表简介及元素周期表提供的信息元素周期表简介及元素周期表提供的信息
- 自然界的水自然界的水
- 爱护水资源爱护水资源
- 自来水净化自来水净化
- 过滤过滤
- 硬水和软水硬水和软水
- 氢气的性质与检验氢气的性质与检验
- 水的组成实验水的组成实验
- 纯净物的分类――单质、化合物、氧化物纯净物的分类――单质、化合物、氧化物
- 化学式的意义化学式的意义
- 化学式的读写化学式的读写
- 化合价化合价
- 化合价的应用化合价的应用
- 原子团原子团
- 化学符号及周边数字的意义化学符号及周边数字的意义
- 有关相对分子质量的计算有关相对分子质量的计算
- 化学方程式化学方程式
- 化学反应前后物质的质量关系的实验探究化学反应前后物质的质量关系的实验探究
- 质量守恒定律质量守恒定律
- 实验探究质量守恒定律时应注意的问题实验探究质量守恒定律时应注意的问题
- 质量守恒定律的微观解释质量守恒定律的微观解释
- 质量守恒定律的相关计算质量守恒定律的相关计算
- 化学方程式化学方程式
- 化学方程式的书写原则与步骤化学方程式的书写原则与步骤
- 化学方程式的配平方法化学方程式的配平方法
- 化学方程式的简单计算化学方程式的简单计算
- 碳和碳的氧化物碳和碳的氧化物
- 碳的几种单质碳的几种单质
- 常温下化学性质稳定常温下化学性质稳定
- 碳与氧气的反应——可燃性碳与氧气的反应——可燃性
- 碳与某些氧化物的反应——还原性碳与某些氧化物的反应——还原性
- 二氧化碳的实验室制法二氧化碳的实验室制法
- 二氧化碳的实验室制法原料的选择二氧化碳的实验室制法原料的选择
- 二氧化碳的物理性质二氧化碳的物理性质
- 二氧化碳的化学性质--与水的反应二氧化碳的化学性质--与水的反应
- 二氧化碳的化学性质--与澄清石灰水的反应二氧化碳的化学性质--与澄清石灰水的反应
- 二氧化碳的用途及危害二氧化碳的用途及危害
- 一氧化碳的物理性质和毒性一氧化碳的物理性质和毒性
- 一氧化碳的化学性质--可燃性一氧化碳的化学性质--可燃性
- 一氧化碳的化学性质--还原性一氧化碳的化学性质--还原性
- 碳及其化合物的相互转化关系碳及其化合物的相互转化关系
- 燃料及其利用燃料及其利用
- 燃烧和燃烧的条件燃烧和燃烧的条件
- 探究燃烧的条件探究燃烧的条件
- 灭火的原理和方法灭火的原理和方法
- 灭火器灭火器
- 易燃物和易爆物的安全知识易燃物和易爆物的安全知识
- 化学反应中的能量变化化学反应中的能量变化
- 煤和石油煤和石油
- 天然气天然气
- 合理利用与开发化石能源合理利用与开发化石能源
- 使用燃料对环境的影响使用燃料对环境的影响
- 能源的利用与开发能源的利用与开发
- 金属和金属材料金属和金属材料
- 几种重要的金属几种重要的金属
- 合金合金
- 金属与氧气的反应金属与氧气的反应
- 探究金属与盐酸、稀硫酸的反应探究金属与盐酸、稀硫酸的反应
- 金属与盐酸、稀硫酸的反应金属与盐酸、稀硫酸的反应
- 金属与酸反应-图象问题(一)金属与酸反应-图象问题(一)
- 金属与酸反应-图象问题(二)金属与酸反应-图象问题(二)
- 金属与酸反应-天平问题金属与酸反应-天平问题
- 金属与酸反应-混合物计算金属与酸反应-混合物计算
- 置换反应置换反应
- 探究金属活动性顺序探究金属活动性顺序
- 金属活动性顺序及其应用金属活动性顺序及其应用
- 选择试剂验证金属的活动性顺序选择试剂验证金属的活动性顺序
- 金属质量变化的判断金属质量变化的判断
- 滤液与滤渣滤液与滤渣
- 金属流程金属流程
- 金属资源的利用和保护金属资源的利用和保护
- 金属在自然界中的存在金属在自然界中的存在
- 工业炼铁工业炼铁
- 一氧化碳还原氧化铁实验一氧化碳还原氧化铁实验
- 铁生锈条件的探究铁生锈条件的探究
- 金属资源保护金属资源保护
- 溶液溶液
- 溶液的形成、概念及特征溶液的形成、概念及特征
- 溶液的组成、命名及用途溶液的组成、命名及用途
- 溶解时的吸热或放热现象溶解时的吸热或放热现象
- 乳化现象乳化现象
- 饱和溶液和不饱和溶液饱和溶液和不饱和溶液
- 饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系
- 结晶结晶
- 固体溶解度固体溶解度
- 固体溶解度的表示方法固体溶解度的表示方法
- 固体溶解度曲线的应用固体溶解度曲线的应用
- 气体溶解度气体溶解度
- 溶质的质量分数溶质的质量分数
- 溶质质量分数和溶解度的区别和联系溶质质量分数和溶解度的区别和联系
- 溶液计算―直接计算溶液计算―直接计算
- 溶液计算―稀释、浓缩问题溶液计算―稀释、浓缩问题
- 溶液计算―与化学方程式的相关计算溶液计算―与化学方程式的相关计算
- 溶液的配制溶液的配制
- 酸和碱酸和碱
- 酸、碱与指示剂作用酸、碱与指示剂作用
- 几种常见的酸几种常见的酸
- 浓硫酸的腐蚀性浓硫酸的腐蚀性
- 浓硫酸的稀释浓硫酸的稀释
- 酸的化学性质酸的化学性质
- 酸与金属氧化物的应用酸与金属氧化物的应用
- 几种常见的碱--氢氧化钠几种常见的碱--氢氧化钠
- 几种常见的碱--氢氧化钙几种常见的碱--氢氧化钙
- 碱的化学性质碱的化学性质
- 酸、碱分别具有相似化学性质的原因酸、碱分别具有相似化学性质的原因
- 中和反应中和反应
- 中和反应在实际中的应用中和反应在实际中的应用
- 溶液酸碱度的表示法-pH溶液酸碱度的表示法-pH
- 中和反应的验证中和反应的验证
- 溶液pH变化问题溶液pH变化问题
- 盐、化肥盐、化肥
- 氯化钠氯化钠
- 粗盐中难溶性杂质的去除粗盐中难溶性杂质的去除
- 碳酸钙碳酸钙
- 碳酸钠碳酸钠
- 碳酸氢钠碳酸氢钠
- 碳酸根离子的检验碳酸根离子的检验
- 复分解反应复分解反应
- 常见化肥的种类和作用常见化肥的种类和作用
- 化肥的简易鉴别化肥的简易鉴别
- 氮肥的简单鉴别氮肥的简单鉴别
- 化学与生活化学与生活
- 蛋白质蛋白质
- 糖类糖类
- 油脂和维生素油脂和维生素
- 化学元素与人体健康化学元素与人体健康
- 有机化合物有机化合物
- 有机合成材料有机合成材料
《化学方程式的简单计算》化学方程式的简单计算
1单选题
现有反应:4A+5B=4C+6D,已知C与D的相对分子质量之比为 5:3,现将17g A,与一定质量B恰好完全反应,生成30g C,则该反应中B与D的质量比为( )
题目答案
您的答案
答案解析
分析:
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和.
解答:
设生成D的质量为x,
4A+5B=4C+6D,
20 18
30g x
$\frac {20}{30g}$=$\frac {18}{x}$x=27g,
参加反应的B的质量为:30g+27g-17g=40g,
则该反应中B与D的质量比为:40g:27g=40:27.
故选:A.
点评:
化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础.
2单选题
某维生素具有抗坏血病的作用,该维生素的相对分子质量为176.取该维生素8.8g可与8g氧气刚好完全反应,生成13.2gCO$_2$和3.6gH$_2$O.该维生素的化学式是( )
题目答案
您的答案
答案解析
分析:
根据质量守恒定律结合“该维生素8.8g可与8g氧气刚好完全反应,生成13.2gCO$_2$和3.6gH$_2$O”分别计算出有机物中C、H元素质量和,然后计算出乳酸中氧元素的质量,由有机物中C、H、O元素的质量及有相对原子质量推断该维生素的化学式.
解答:
解:根据质量守恒定律可知,该维生素中一定含有碳元素和氢元素,是否含有氧元素需计算才能知道;
13.2gCO$_2$中C元素的质量=13.2g×($\frac {12}{44}$×100%)=3.6g;3.6gH$_2$O中H元素的质量=3.6g×$\frac {2}{18}$×100%=0.4g,根据质量守恒定律可知该维生素中O元素质量为8.8g-3.6g-0.4g=4.8g;
则该维生素中C、H、O原子个数比为$\frac {3.6g}{12}$:$\frac {0.4g}{1}$:$\frac {4.8g}{16}$=3:4:3,则该维生素的化学式是C$_3$nH$_4$nO$_3$n.又该维生素的相对分子质量为176,所以该维生素的化学式是C$_6$H$_8$O$_6$.
故选A.
点评:
本题难度不大,掌握有关化学式的计算方法是解题的关键.
3单选题
一定条件下,一定量的化合物A和O$_2$恰好完全反应,生成44gCO$_2$和9gH$_2$O,则A物质的相对分子质量不可能是( )
题目答案
您的答案
答案解析
分析:
根据质量守恒定律结合题意可知,“一定量的化合物A和O$_2$恰好完全反应,生成44gCO$_2$和9gH$_2$O”,则可求44gCO$_2$的碳元素的质量、9gH$_2$O中氢元素的质量,得出有机物中碳、氢元素的原子个数比;再设有机物的化学式通式,用正整数代入验证.
解答:
解:由“一定量的化合物A和O$_2$恰好完全反应,生成44gCO$_2$和9gH$_2$O”,则可求44gCO$_2$的碳元素的质量为12克、9gH$_2$O中氢元素的质量得1克,则有机物中碳、氢元素的原子个数比为1:1;则该物质化学式可表示为C_mH_mO_n,相对分子质量=13m+16n.当m=2,n=0时,物质为C$_2$H$_2$,A正确.当m=2,n=2时,物质为C$_2$H$_2$O$_2$,C正确.当m=2,n=4时,物质为C$_2$H$_2$O$_4$,D正确.均有正整数对m,n使A,C,D成立,而对B则没有.
故选B.
点评:
根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和,
4单选题
潜水员的呼吸面具用Na$_2$O$_2$与人体呼出的CO$_2$反应来制取氧气,供潜水员呼吸,其化学反应为:2Na$_2$O$_2$+2CO$_2$═2x+O$_2$
39克Na$_2$O$_2$完全反应,可放出O$_2${_ _}克.
题目答案
您的答案
答案解析
分析:
由过氧化钠的质量根据化学方程式可以计算出生成氧气的质量.
解答:
解:设生成氧气的质量为x,
2Na$_2$O$_2$+2CO$_2$=2Na$_2$CO$_3$+O$_2$
156 32
39g x
$\frac {156}{32}$=$\frac {39g}{x}$
解得:x=8g,
故答案为:8.
点评:
在推断物质的化学式时,一定要注意x前是否有化学计量数.
5填空题
(1)已知反应:3A+2B═2C+D,其中A、B两物质完全反应时的质量比为3:4.若生成C和D共140g,则该反应消耗B的质量为克.
(2)在化学反应3X+4Y═2Z中,已知X和Z的相对分子质量分别是32和102,则Y的相对分子质量为;如果制取Z 102g,则需要Y物质g.
(3)根据化学方程式A+NaOH═B+H$_2$O推断,B、A的相对分子质量相差.
题目答案
您的答案
答案解析
分析:
(1)根据质量守恒定律可知参加化学反应的各物质质量总和等于反应后生成的各物质质量总和,即参加反应的A和B的质量和跟生成C和D的质量和相等.
(2)根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.此题中,参加反应的X和Y的质量和应等于生成物Z的质量,由X和Z的相对分子质量可求Y的相对分子质量.
(3)可以根据质量守恒定律,化学反应前后物质的总质量不变,求出B、A的相对分子质量之差,据此分析解答即可.
解答:
解:(1)由质量守恒定律和3A+2B=2C+D,生成C和D共140g,则参加反应的A和B的质量之和也为140g,而A、B两物质完全反应时的质量比为3:4,故反应消耗B的质量是140g×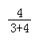 =80g.
=80g.
故填:80.
(2)设则Y的相对分子质量为y,设需要Y的质量为z,则
3X+4Y═2Z
3×32 4y 2×102
z 102g
3×32+4×y=2×102,解得y=27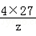 =
=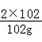 ,解得z=54g
,解得z=54g
故填:27;54.
(3)根据质量守恒定律,A的相对分子质量加上氢氧化钠的相对分子质量等于B的相对分子质量加上水的相对分子质量,A+40═B+18,故B、A的相对分子质量之差为:B﹣A=40﹣18=22.
故填:22.
点评:
解此题的关键是要知道在方程式中找各物质的质量关系时,相对分子质量需要乘以化学计量数.
6填空题
在4P+5O$_2$═2P$_2$O$_5$中,各物质的分子个数比为::,各物质的质量比是::.
题目答案
您的答案
答案解析
分析:
化学方程式的意义可知:1、表示什么物质参加反应,结果生成了什么物质;2、表示个物质间的原子和分子的个数比;3、表示反应在什么条件下进行;4、表示反应物,生成物各物质间的质量比;通过仔细观察和正确的读法即可找出答案.
解答:
解:
由化学方程式的意义可知:
①反应物磷和氧气的分子个数分别为4和5,生成物氧气的分子个数为2,故各物质的分子个数比为4:5:2;
②反应物磷的质量为4×31=124,氧气的质量为5×32=160,生成物五氧化二磷的质量为124+160=284,各物质的质量比为124:160;284=31:40:71.
故答案为:4:5:2; 31:40:71.
点评:
本题是一道考查化学方程式概念、意义和读法的题目,是初中化学的重点也是难点.化学方程式是化学反应简明的表达形式.它从"质"和"量"两个方面表达了化学反应的意义.(1)"质"的含义 表示什么物质参加了反应,生成了什么物质,以及反应是在什么条件下进行的.(2)"量"的含义 从宏观看,表示了各反应物、生成物间的质量比.如果反应物都是气体,还能表示它们在反应时的体积比.从微观看,如果各反应物、生成物都是由分子构成的,那么化学方程式还表示各反应物、生成物间的分子个数比.
7填空题
3Fe+2O$_2$$\xlongequal[]{点燃}$Fe$_3$O$_4$反应中,份质量的铁与份质量的氧气反应生成份质量的四氧化三铁,这三种物质之间的质量之比为::.
题目答案
您的答案
答案解析
分析:
化学方程式可表示:反应物和生成物的种类;反应的条件;反应物和生成物的微观粒子个数比;反应物和生成物的质量比等.但要注意读化学方程式时,"+"应读作"和","═"应读作"生成".根据相对分子质量及化学式前的化学计量数即可得出答案.
解答:
解:物质的质量比等于相对分子质量和的比.
3Fe+2O$_2$$\xlongequal[]{点燃}$Fe$_3$O$_4$
168 64 232
则三者的质量比是168:64:232
故答案为:168;64;232;21:8:29
点评:
本题主要考查学生对元素的相对原子质量和化学方程式意义的认识.