- 无机化学基础无机化学基础
- 物质的量物质的量
- 物质的量与阿伏伽德罗常数物质的量与阿伏伽德罗常数
- 物质的量浓度物质的量浓度
- 物质的组成性质和分类物质的组成性质和分类
- 离子反应离子反应
- 离子反应 离子方程式离子反应 离子方程式
- 离子共存离子共存
- 氧化还原反应氧化还原反应
- 氧化还原反应的基本概念氧化还原反应的基本概念
- 氧化性和还原性的强弱判断氧化性和还原性的强弱判断
- 氧化还原反应的规律及应用氧化还原反应的规律及应用
- 钠镁铝及其化合物钠镁铝及其化合物
- 钠及其重要化合物钠及其重要化合物
- 碱金属及焰色反应碱金属及焰色反应
- 镁铝及其化合物镁铝及其化合物
- 铝及其化合物的图像和计算铝及其化合物的图像和计算
- 铁铜及其化合物铁铜及其化合物
- 铁及其化合物铁及其化合物
- 铜及其化合物铜及其化合物
- 碳硅及其非金属材料碳硅及其非金属材料
- 碳、硅及其化合物碳、硅及其化合物
- 无机非金属材料无机非金属材料
- 氯及其化合物氯及其化合物
- 氯气氯气
- 氯水、次氯酸及其盐氯水、次氯酸及其盐
- 卤素单质及其化合物的性质卤素单质及其化合物的性质
- 氧硫及其化合物氧硫及其化合物
- 硫及其化合物硫及其化合物
- 氧族元素及臭氧、过氧化性的性质和用途氧族元素及臭氧、过氧化性的性质和用途
- 氮其化合物氮其化合物
- 氮、磷及其化合物氮、磷及其化合物
- 氨气 铵盐氨气 铵盐
- 硝酸及其性质硝酸及其性质
- 化学反应原理化学反应原理
- 原子结构和化学键原子结构和化学键
- 原子结构原子结构
- 化学键化学键
- 元素周期律和元素周期表元素周期律和元素周期表
- 元素周期表元素周期表
- 元素周期律元素周期律
- 化学反应的热效应化学反应的热效应
- 反应热与能量变化的关系反应热与能量变化的关系
- 热化学方程式热化学方程式
- 盖斯定律的应用及反应热的计算盖斯定律的应用及反应热的计算
- 电化学电化学
- 原电池原理原电池原理
- 化学电源化学电源
- 电解原理及其应用电解原理及其应用
- 金属的腐蚀和防护金属的腐蚀和防护
- 化学反应速率化学反应速率
- 化学反应速率化学反应速率
- 化学反应速率的影响因素化学反应速率的影响因素
- 化学平衡化学平衡
- 化学平衡状态化学平衡状态
- 化学平衡常数及转化率的相关计算化学平衡常数及转化率的相关计算
- 化学平衡的移动和化学反应进行的方向化学平衡的移动和化学反应进行的方向
- 弱电解质的电离平衡弱电解质的电离平衡
- 弱电解质的溶解平衡弱电解质的溶解平衡
- 电离平衡常数及其应用电离平衡常数及其应用
- 水的电离和溶液的酸碱性水的电离和溶液的酸碱性
- 水的电离平衡及影响因素水的电离平衡及影响因素
- 溶液的pH及pH的相关计算溶液的pH及pH的相关计算
- 酸碱中和滴定酸碱中和滴定
- 盐类的水解盐类的水解
- 盐类水解及其应用盐类水解及其应用
- 粒子浓度的大小比较粒子浓度的大小比较
- 三大守恒三大守恒
- 难溶电解质的溶解平衡难溶电解质的溶解平衡
- 难溶电解质的溶解平衡难溶电解质的溶解平衡
- Ksp图像及其计算Ksp图像及其计算
- 有机化学与实验操作有机化学与实验操作
- 重要的烃 化石燃料重要的烃 化石燃料
- 同系物和同分异构体同系物和同分异构体
- 化石燃料化石燃料
- 有机物的结构分类与命名有机物的结构分类与命名
- 有机化合物命名有机化合物命名
- 研究有机化合物的步骤和方法研究有机化合物的步骤和方法
- 有机化合物的分类有机化合物的分类
- 烃与卤代烃烃与卤代烃
- 烃的结构与性质烃的结构与性质
- 卤代烃的结构与性质卤代烃的结构与性质
- 烃的含氧衍生物烃的含氧衍生物
- 醇、酚的结构与性质醇、酚的结构与性质
- 醛的结构与性质醛的结构与性质
- 羧酸、酯的结构与性质羧酸、酯的结构与性质
- 高分子化合物 有机合成与推断高分子化合物 有机合成与推断
- 基本营养物质基本营养物质
- 油脂油脂
- 糖类糖类
- 蛋白质蛋白质
- 化学常用仪器和基本操作化学常用仪器和基本操作
- 基本仪器的使用与药品的保存基本仪器的使用与药品的保存
- 基本操作与实验安全基本操作与实验安全
- 物质的检验、分离和提纯物质的检验、分离和提纯
- 物质的检验与鉴别物质的检验与鉴别
- 物质的分离与提纯物质的分离与提纯
- 实验综合探究、设计与评价实验综合探究、设计与评价
- 常见气体的制备实验常见气体的制备实验
- 实验方案的设计与评价实验方案的设计与评价
- 探究性实验探究性实验
- 定量实验之滴定实验定量实验之滴定实验
- 物质的结构与性质物质的结构与性质
- 原子结构与性质原子结构与性质
- 分子结构与性质分子结构与性质
- 晶体结构与性质晶体结构与性质
《元素周期表》知识速查
元素周期表的结构
1.编排原则
(1)周期:将电子层数相同的元素,按原子序数递增的顺序从左到右排成横行,这样每个横行为一个周期。
(2)族:将不同横行(即周期)中最外层电子数相同的元素,按电子层数递增的顺序由上到下排成纵列,这样每个纵列为一族。
2.元素周期表的结构
(1)周期(7个横行,7个周期)
短周期 | 长周期 | ||||||
序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
元素种数 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
0族元素原子序数 | 2 | 10 | 18 | 36 | 54 | 86 | 118 |
(2)族(18个纵行,16个族)
主族 | 列 | 1 | 2 | 13 | 14 | 15 | 16 | 17 |
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
副族 | 列 | 3 | 4 | 5 | 6 | 7 | 11 | 12 |
族 | ⅢB | ⅣB | ⅤB | ⅥB | ⅦB | ⅠB | ⅡB | |
Ⅷ族 | 第8、9、10,共3个纵行 | |||||||
0族 | 第18纵行 | |||||||
(3)元素周期表中的特殊位置
①过渡元素:元素周期表中从ⅢB族到ⅡB族10个纵列共60多种元素,这些元素都是金属元素。
②镧系:元素周期表第6周期中,57号元素镧到71号元素镥共15种元素。
③锕系:元素周期表第7周期中,89号元素锕到103号元素铹共15种元素。
④超铀元素:在锕系元素中,92号元素铀(U)以后的各种元素。
【注意】
(1)第一张元素周期表是由俄国化学家门捷列夫绘制完成的。
(2)含元素种类最多的族是ⅢB族,共有32种元素。
(3)过渡元素包括7个副族和第Ⅷ族,全部是金属元素,原子最外层电子数不超过2个(1~2个)。
(4)最外层电子数为3~7个的原子一定属于主族元素,且最外层电子数即为主族的族序数。
元素周期表中元素的分区及3大应用
1.元素周期表中元素的分区
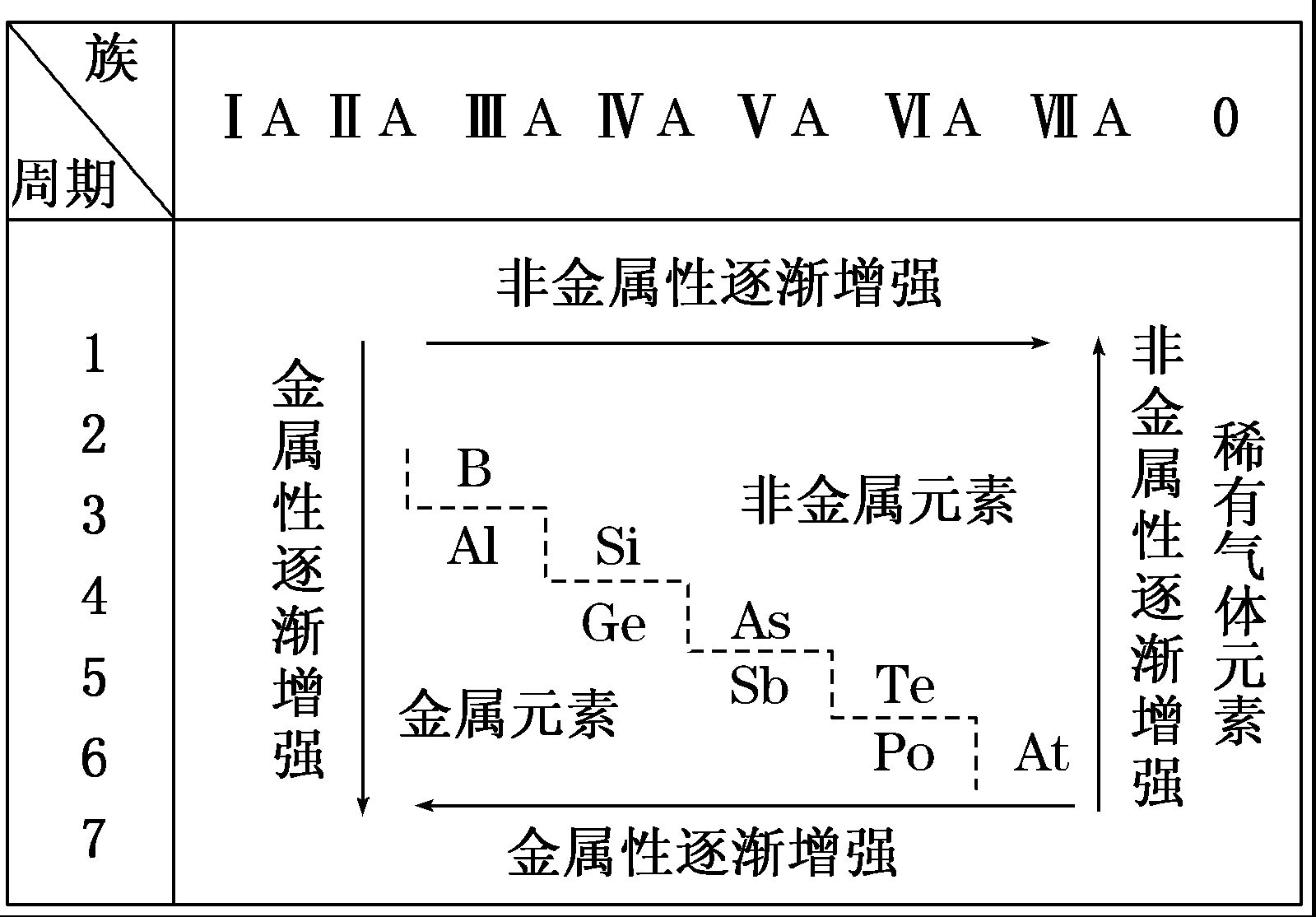
(1)分界线:如图所示,沿着元素周期表中铝、锗、锑、钋与硼、硅、砷、碲、砹的交界处画一条斜线,即为金属元素区和非金属元素区分界线(氢元素除外)。
(2)各区位置:分界线左下方为金属元素区,分界线右上方为非金属元素区。
(3)分界线附近元素的性质:既表现金属元素的性质,又表现非金属元素的性质。
2.元素周期表的三大应用
(1)科学预测:为新元素的发现及预测他们的原子结构和性质提供了线索。
(2)寻找新材料

【注意】
处在金属元素和非金属元素分界线上下的元素单质并不一定是半导体,如Al是导体,B(硼)不导电。
(3)用于工农业生产
对探矿有指导意义的是地球化学元素的分布与它们在元素周期表中的位置关系,研制农药材料等。
元素周期表中的4个关系
1.常见的四组等量关系
(1)核电荷数=质子数=原子序数;
(2)核外电子层数=周期序数;
(3)主族序数=最外层电子数=最高正价;
(4)非金属元素:最低负价=最高正价-8。
2.同主族元素的原子序数差的关系
(1)位于过渡元素左侧的主族元素,即第ⅠA、第ⅡA族,同主族、邻周期元素原子序数之差为上一周期元素所在周期所含元素种数;如钠、钾的原子序数之差为19-11=8。
(2)位于过渡元素右侧的主族元素,即第ⅢA~第ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素种数。如氯和溴的原子序数之差为35-17=18(溴所在第四周期所含元素的种数)。
3.同周期第ⅡA族和第ⅢA族元素原子序数差的关系
周期序数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
原子序数差 | 无 | 1 | 1 | 11 | 11 | 25 | 25 |
原因 | 增加了过渡元素 | 增加了过渡元素和镧系或锕系元素 | |||||
4.奇偶关系
(1)原子序数是奇数的主族元素,其所在主族序数必为奇数。
(2)原子序数是偶数的主族元素,其所在主族序数必为偶数。
如:如图为元素周期表中五种元素的相对位置:若B的原子序数为a,则这五种元素的核电荷数之和可能为:5a;5a+10;5a+14。