- 无机化学基础无机化学基础
- 物质的量物质的量
- 物质的量与阿伏伽德罗常数物质的量与阿伏伽德罗常数
- 物质的量浓度物质的量浓度
- 物质的组成性质和分类物质的组成性质和分类
- 离子反应离子反应
- 离子反应 离子方程式离子反应 离子方程式
- 离子共存离子共存
- 氧化还原反应氧化还原反应
- 氧化还原反应的基本概念氧化还原反应的基本概念
- 氧化性和还原性的强弱判断氧化性和还原性的强弱判断
- 氧化还原反应的规律及应用氧化还原反应的规律及应用
- 钠镁铝及其化合物钠镁铝及其化合物
- 钠及其重要化合物钠及其重要化合物
- 碱金属及焰色反应碱金属及焰色反应
- 镁铝及其化合物镁铝及其化合物
- 铝及其化合物的图像和计算铝及其化合物的图像和计算
- 铁铜及其化合物铁铜及其化合物
- 铁及其化合物铁及其化合物
- 铜及其化合物铜及其化合物
- 碳硅及其非金属材料碳硅及其非金属材料
- 碳、硅及其化合物碳、硅及其化合物
- 无机非金属材料无机非金属材料
- 氯及其化合物氯及其化合物
- 氯气氯气
- 氯水、次氯酸及其盐氯水、次氯酸及其盐
- 卤素单质及其化合物的性质卤素单质及其化合物的性质
- 氧硫及其化合物氧硫及其化合物
- 硫及其化合物硫及其化合物
- 氧族元素及臭氧、过氧化性的性质和用途氧族元素及臭氧、过氧化性的性质和用途
- 氮其化合物氮其化合物
- 氮、磷及其化合物氮、磷及其化合物
- 氨气 铵盐氨气 铵盐
- 硝酸及其性质硝酸及其性质
- 化学反应原理化学反应原理
- 原子结构和化学键原子结构和化学键
- 原子结构原子结构
- 化学键化学键
- 元素周期律和元素周期表元素周期律和元素周期表
- 元素周期表元素周期表
- 元素周期律元素周期律
- 化学反应的热效应化学反应的热效应
- 反应热与能量变化的关系反应热与能量变化的关系
- 热化学方程式热化学方程式
- 盖斯定律的应用及反应热的计算盖斯定律的应用及反应热的计算
- 电化学电化学
- 原电池原理原电池原理
- 化学电源化学电源
- 电解原理及其应用电解原理及其应用
- 金属的腐蚀和防护金属的腐蚀和防护
- 化学反应速率化学反应速率
- 化学反应速率化学反应速率
- 化学反应速率的影响因素化学反应速率的影响因素
- 化学平衡化学平衡
- 化学平衡状态化学平衡状态
- 化学平衡常数及转化率的相关计算化学平衡常数及转化率的相关计算
- 化学平衡的移动和化学反应进行的方向化学平衡的移动和化学反应进行的方向
- 弱电解质的电离平衡弱电解质的电离平衡
- 弱电解质的溶解平衡弱电解质的溶解平衡
- 电离平衡常数及其应用电离平衡常数及其应用
- 水的电离和溶液的酸碱性水的电离和溶液的酸碱性
- 水的电离平衡及影响因素水的电离平衡及影响因素
- 溶液的pH及pH的相关计算溶液的pH及pH的相关计算
- 酸碱中和滴定酸碱中和滴定
- 盐类的水解盐类的水解
- 盐类水解及其应用盐类水解及其应用
- 粒子浓度的大小比较粒子浓度的大小比较
- 三大守恒三大守恒
- 难溶电解质的溶解平衡难溶电解质的溶解平衡
- 难溶电解质的溶解平衡难溶电解质的溶解平衡
- Ksp图像及其计算Ksp图像及其计算
- 有机化学与实验操作有机化学与实验操作
- 重要的烃 化石燃料重要的烃 化石燃料
- 同系物和同分异构体同系物和同分异构体
- 化石燃料化石燃料
- 有机物的结构分类与命名有机物的结构分类与命名
- 有机化合物命名有机化合物命名
- 研究有机化合物的步骤和方法研究有机化合物的步骤和方法
- 有机化合物的分类有机化合物的分类
- 烃与卤代烃烃与卤代烃
- 烃的结构与性质烃的结构与性质
- 卤代烃的结构与性质卤代烃的结构与性质
- 烃的含氧衍生物烃的含氧衍生物
- 醇、酚的结构与性质醇、酚的结构与性质
- 醛的结构与性质醛的结构与性质
- 羧酸、酯的结构与性质羧酸、酯的结构与性质
- 高分子化合物 有机合成与推断高分子化合物 有机合成与推断
- 基本营养物质基本营养物质
- 油脂油脂
- 糖类糖类
- 蛋白质蛋白质
- 化学常用仪器和基本操作化学常用仪器和基本操作
- 基本仪器的使用与药品的保存基本仪器的使用与药品的保存
- 基本操作与实验安全基本操作与实验安全
- 物质的检验、分离和提纯物质的检验、分离和提纯
- 物质的检验与鉴别物质的检验与鉴别
- 物质的分离与提纯物质的分离与提纯
- 实验综合探究、设计与评价实验综合探究、设计与评价
- 常见气体的制备实验常见气体的制备实验
- 实验方案的设计与评价实验方案的设计与评价
- 探究性实验探究性实验
- 定量实验之滴定实验定量实验之滴定实验
- 物质的结构与性质物质的结构与性质
- 原子结构与性质原子结构与性质
- 分子结构与性质分子结构与性质
- 晶体结构与性质晶体结构与性质
《电离平衡常数及其应用》知识速查
电离平衡常数


强酸(碱)与弱酸(碱)的比较
①一元强酸(HA)与一元弱酸(HB)的比较
浓度均为0.01 mol·L-1 | pH均为2 | |
pH或物质的量浓度 | 2=pHHA<pHHB | 0.01 mol·L-1=c(HA)<c(HB) |
开始与金属反应的速率 | HA>HB | HA=HB |
体积相同时与过量的碱反应 消耗碱的量 | HA=HB | HA<HB |
体积相同时与过量活泼金属反应 产生H2的量 | HA=HB | HA<HB |
c(A-)与c(B-)大小 | c(A-)>c(B-) | c(A-)=c(B-) |
分别加入固体NaA、NaB后pH变化 | HA:不变 HB:变大 | HA:不变 HB:变大 |
加水稀释10倍后 | 3=pHHA<pHHB | 3=pHHA>pHHB>2 |
溶液的导电性 | HA>HB | HA=HB |
水的电离程度 | HA<HB | HA=HB |
②判断弱酸的三种方法
方法一:根据弱酸的定义判断,弱酸在水溶液中不能完全电离,如测0.1 mol·L-1的CH3COOH溶液的pH>1。
方法二:根据弱酸在水溶液中存在电离平衡判断,条件改变,平衡发生移动,如pH=1的CH3COOH加水稀释10倍后,1<pH<2。
方法三:根据弱酸的正盐能发生水解判断,如判断CH3COOH为弱酸可做以下实验:
A.向一定浓度的醋酸钠溶液中,加入几滴酚酞溶液,溶液变为浅红色。
B.用玻璃棒蘸取一定浓度的醋酸钠溶液滴在pH试纸上,测其pH>7。
③盐酸、醋酸稀释时溶液pH变化特点比较
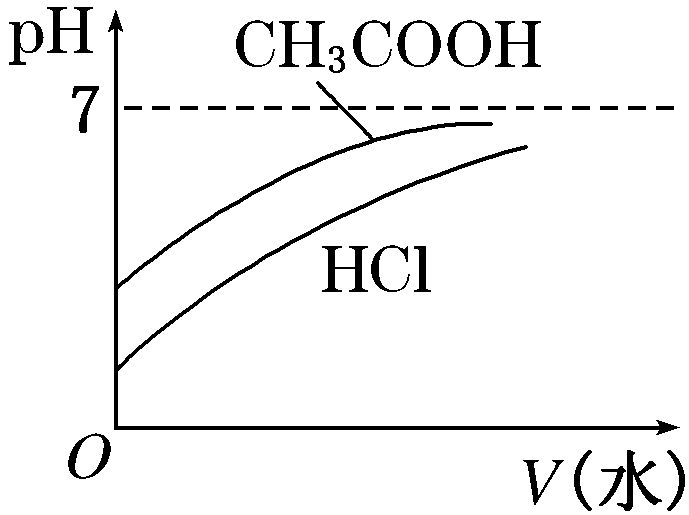
A.相同体积、相同浓度的盐酸、醋酸
加水稀释相同的倍数,醋酸的pH大。
加水稀释到相同的pH,盐酸加入的水多。
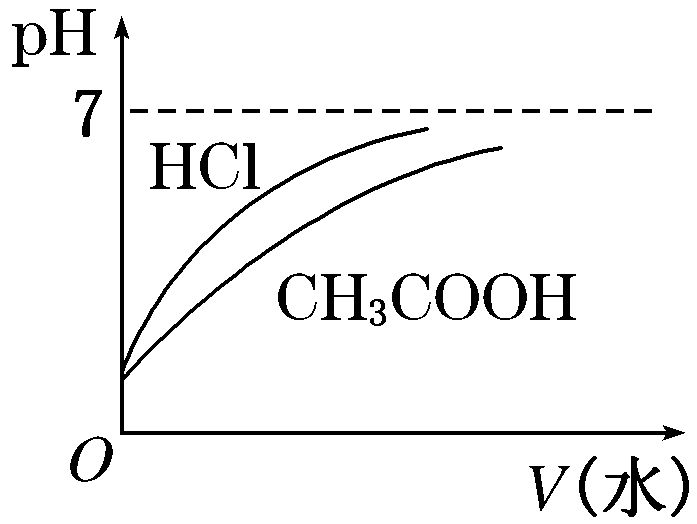
B.相同体积、相同pH的盐酸、醋酸
加水稀释相同的倍数,盐酸的pH大。
加水稀释到相同的pH,醋酸加入的水多。
C.不论怎样稀释,酸溶液的pH不能等于或大于7,碱溶液的pH不能等于或小于7,都只能趋近于7。